આપણા ગ્રહનો સૌથી મહત્વપૂર્ણ પદાર્થ, તેના ગુણધર્મો અને રચનામાં અનન્ય, અલબત્ત, પાણી છે. છેવટે, તે તેણીને આભારી છે કે પૃથ્વી પર જીવન છે, જ્યારે આજે જાણીતા સૌરમંડળના અન્ય પદાર્થો પર કોઈ જીવન નથી. ઘન, પ્રવાહી, વરાળના સ્વરૂપમાં - તેમાંથી કોઈપણ જરૂરી અને મહત્વપૂર્ણ છે. પાણી અને તેના ગુણધર્મ એ સમગ્ર વૈજ્ઞાનિક શિસ્ત - હાઇડ્રોલોજીના અભ્યાસનો વિષય છે.
પૃથ્વી પર પાણીનો જથ્થો
જો આપણે એકત્રીકરણના તમામ રાજ્યોમાં આ ઓક્સાઇડની માત્રાના સૂચકને ધ્યાનમાં લઈએ, તો તે ગ્રહ પરના કુલ સમૂહના લગભગ 75% છે. આ કિસ્સામાં, વ્યક્તિએ કાર્બનિક સંયોજનો, જીવંત વસ્તુઓ, ખનિજો અને અન્ય તત્વોમાં બંધાયેલ પાણીને ધ્યાનમાં લેવું જોઈએ.
જો આપણે પાણીની માત્ર પ્રવાહી અને નક્કર સ્થિતિને ધ્યાનમાં લઈએ, તો આંકડો ઘટીને 70.8% થઈ જાય છે. ચાલો વિચાર કરીએ કે આ ટકાવારી કેવી રીતે વિતરિત કરવામાં આવે છે, જ્યાં પ્રશ્નમાં પદાર્થ સમાયેલ છે.
- મહાસાગરો અને સમુદ્રોમાં 360 મિલિયન કિમી 2 ખારા પાણી અને પૃથ્વી પર ખારા તળાવો છે.
- તાજા પાણીનું વિતરણ અસમાન રીતે થાય છે: તેમાંથી 16.3 મિલિયન કિમી 2 ગ્રીનલેન્ડ, આર્કટિક અને એન્ટાર્કટિકાના હિમનદીઓમાં બરફમાં ઘેરાયેલું છે.
- 5.3 મિલિયન કિમી 2 હાઇડ્રોજન ઓક્સાઇડ તાજી નદીઓ, સ્વેમ્પ્સ અને તળાવોમાં કેન્દ્રિત છે.
- ભૂગર્ભજળ 100 મિલિયન m3 જેટલું છે.
તેથી જ દૂરના અંતરિક્ષમાંથી અવકાશયાત્રીઓ પૃથ્વીને વાદળી બોલના આકારમાં જમીનના દુર્લભ સમાવેશ સાથે જોઈ શકે છે. પાણી અને તેના ગુણધર્મો, તેની માળખાકીય વિશેષતાઓનું જ્ઞાન વિજ્ઞાનના મહત્વના ઘટકો છે. વધુમાં, તાજેતરમાં માનવતાએ તાજા પાણીની સ્પષ્ટ અછત અનુભવવાનું શરૂ કર્યું છે. કદાચ આવા જ્ઞાન આ સમસ્યાને ઉકેલવામાં મદદ કરશે.
પાણી અને પરમાણુ બંધારણની રચના
જો આપણે આ સૂચકાંકોને ધ્યાનમાં લઈએ, તો આ અદ્ભુત પદાર્થ જે ગુણધર્મો દર્શાવે છે તે તરત જ સ્પષ્ટ થઈ જશે. આમ, પાણીના પરમાણુમાં બે હાઇડ્રોજન અણુ અને એક ઓક્સિજન પરમાણુ હોય છે, તેથી તે પ્રયોગમૂલક સૂત્ર H 2 O ધરાવે છે. વધુમાં, બંને તત્વોના ઇલેક્ટ્રોન પોતે પરમાણુના નિર્માણમાં મહત્વપૂર્ણ ભૂમિકા ભજવે છે. ચાલો જોઈએ કે પાણીની રચના અને તેના ગુણધર્મો શું છે.

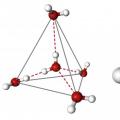
તે સ્પષ્ટ છે કે દરેક પરમાણુ બીજાની આસપાસ લક્ષી છે, અને તેઓ સાથે મળીને એક સામાન્ય સ્ફટિક જાળી બનાવે છે. તે રસપ્રદ છે કે ઓક્સાઇડ ટેટ્રાહેડ્રોનના આકારમાં બાંધવામાં આવે છે - કેન્દ્રમાં એક ઓક્સિજન અણુ, અને તેની આસપાસ બે જોડી ઇલેક્ટ્રોન અને બે હાઇડ્રોજન અણુ અસમપ્રમાણતાથી. જો તમે અણુના મધ્યવર્તી કેન્દ્રો દ્વારા રેખાઓ દોરો અને તેમને જોડો, તો તમને બરાબર ટેટ્રેહેડ્રલ ભૌમિતિક આકાર મળશે.
ઓક્સિજન અણુના કેન્દ્ર અને હાઇડ્રોજન ન્યુક્લી વચ્ચેનો ખૂણો 104.5 0 C. O-H બોન્ડ લંબાઈ = 0.0957 nm છે. ઓક્સિજનના ઇલેક્ટ્રોન જોડીની હાજરી, તેમજ હાઇડ્રોજનની તુલનામાં તેની વધુ ઇલેક્ટ્રોન જોડાણ, પરમાણુમાં નકારાત્મક ચાર્જ ફીલ્ડની રચનાની ખાતરી કરે છે. તેનાથી વિપરીત, હાઇડ્રોજન ન્યુક્લી એ સંયોજનનો હકારાત્મક ચાર્જ થયેલ ભાગ બનાવે છે. આમ, તે તારણ આપે છે કે પાણીનો પરમાણુ દ્વિધ્રુવ છે. આ નક્કી કરે છે કે પાણી શું હોઈ શકે છે, અને તેના ભૌતિક ગુણધર્મો પણ પરમાણુની રચના પર આધારિત છે. જીવંત પ્રાણીઓ માટે, આ લક્ષણો મહત્વપૂર્ણ ભૂમિકા ભજવે છે.
મૂળભૂત ભૌતિક ગુણધર્મો
આમાં સામાન્ય રીતે સ્ફટિક જાળી, ઉત્કલન અને ગલનબિંદુઓ અને વિશેષ વ્યક્તિગત લાક્ષણિકતાઓનો સમાવેશ થાય છે. ચાલો તે બધાને ધ્યાનમાં લઈએ.
- હાઇડ્રોજન ઓક્સાઇડની સ્ફટિક જાળીની રચના એકત્રીકરણની સ્થિતિ પર આધારિત છે. તે નક્કર - બરફ, પ્રવાહી - સામાન્ય સ્થિતિમાં મૂળભૂત પાણી, વાયુયુક્ત - વરાળ હોઈ શકે છે જ્યારે પાણીનું તાપમાન 100 0 સે. ઉપર વધે છે. બરફ સુંદર પેટર્નવાળા સ્ફટિકો બનાવે છે. સમગ્ર જાળી છૂટક છે, પરંતુ જોડાણ ખૂબ જ મજબૂત છે અને ઘનતા ઓછી છે. તમે તેને કાચ પર સ્નોવફ્લેક્સ અથવા હિમાચ્છાદિત પેટર્નના ઉદાહરણમાં જોઈ શકો છો. સામાન્ય પાણીમાં, જાળીનો સતત આકાર હોતો નથી, તે બદલાય છે અને એક રાજ્યથી બીજામાં જાય છે.
- બાહ્ય અવકાશમાં પાણીના પરમાણુ નિયમિત ગોળાકાર આકાર ધરાવે છે. જો કે, પૃથ્વીના ગુરુત્વાકર્ષણના પ્રભાવ હેઠળ, તે વિકૃત થાય છે અને પ્રવાહી સ્થિતિમાં જહાજનું સ્વરૂપ લે છે.
- હકીકત એ છે કે હાઇડ્રોજન ઓક્સાઇડ બંધારણમાં દ્વિધ્રુવ છે તે નીચેના ગુણધર્મોને નિર્ધારિત કરે છે: ઉચ્ચ થર્મલ વાહકતા અને ગરમીની ક્ષમતા, જે પદાર્થની ઝડપી ગરમી અને લાંબા ઠંડકમાં જોઇ શકાય છે, આયનો અને વ્યક્તિગત ઇલેક્ટ્રોન અને પોતાની આસપાસના સંયોજનો બંનેને દિશામાન કરવાની ક્ષમતા. . આ પાણીને સાર્વત્રિક દ્રાવક (ધ્રુવીય અને તટસ્થ બંને) બનાવે છે.
- પાણીની રચના અને પરમાણુની રચના આ સંયોજનની બહુવિધ હાઇડ્રોજન બોન્ડ બનાવવાની ક્ષમતાને સમજાવે છે, જેમાં એકલા ઇલેક્ટ્રોન જોડી (એમોનિયા, આલ્કોહોલ અને અન્ય) હોય તેવા અન્ય સંયોજનો સહિત.
- પ્રવાહી પાણીનો ઉત્કલન બિંદુ 100 0 C છે, સ્ફટિકીકરણ +4 0 C પર થાય છે. આ સૂચકની નીચે બરફ છે. જો તમે દબાણ વધારશો, તો પાણીનો ઉત્કલન બિંદુ ઝડપથી વધશે. તેથી, ઉચ્ચ વાતાવરણમાં તેમાં સીસું ઓગળવું શક્ય છે, પરંતુ તે ઉકળે પણ નહીં (300 0 સે.થી વધુ).
- પાણીના ગુણધર્મો જીવંત પ્રાણીઓ માટે ખૂબ જ મહત્વપૂર્ણ છે. ઉદાહરણ તરીકે, એક સૌથી મહત્વપૂર્ણ સપાટી તણાવ છે. આ હાઇડ્રોજન ઓક્સાઇડની સપાટી પર પાતળી રક્ષણાત્મક ફિલ્મની રચના છે. અમે પ્રવાહી પાણી વિશે વાત કરી રહ્યા છીએ. યાંત્રિક ક્રિયા દ્વારા આ ફિલ્મને તોડવી ખૂબ મુશ્કેલ છે. વૈજ્ઞાનિકોએ નક્કી કર્યું છે કે 100 ટન વજન જેટલું બળ જરૂરી છે. તેને કેવી રીતે શોધવું? જ્યારે નળમાંથી પાણી ધીમે ધીમે ટપકતું હોય ત્યારે ફિલ્મ સ્પષ્ટ છે. તે જોઈ શકાય છે કે તે કોઈ પ્રકારના શેલમાં હોય છે, જે ચોક્કસ મર્યાદા અને વજન સુધી ખેંચાય છે અને ગુરુત્વાકર્ષણ દ્વારા સહેજ વિકૃત, ગોળાકાર ટીપાના રૂપમાં બહાર આવે છે. સપાટીના તણાવને કારણે, ઘણી વસ્તુઓ પાણીની સપાટી પર તરતી શકે છે. ખાસ અનુકૂલન સાથે જંતુઓ તેની સાથે મુક્તપણે ખસેડી શકે છે.
- પાણી અને તેના ગુણધર્મો વિસંગત અને અનન્ય છે. ઓર્ગેનોલેપ્ટિક સૂચકાંકો અનુસાર, આ સંયોજન સ્વાદ અથવા ગંધ વિના રંગહીન પ્રવાહી છે. આપણે જેને પાણીનો સ્વાદ કહીએ છીએ તે તેમાં ઓગળેલા ખનિજો અને અન્ય ઘટકો છે.
- પ્રવાહી સ્થિતિમાં હાઇડ્રોજન ઓક્સાઇડની વિદ્યુત વાહકતા તેમાં કેટલા અને કયા ક્ષાર ઓગળેલા છે તેના પર આધાર રાખે છે. નિસ્યંદિત પાણી, જેમાં કોઈ અશુદ્ધિઓ હોતી નથી, તે ઇલેક્ટ્રિક પ્રવાહનું સંચાલન કરતું નથી.
બરફ એ પાણીની વિશેષ સ્થિતિ છે. આ સ્થિતિની રચનામાં, અણુઓ હાઇડ્રોજન બોન્ડ દ્વારા એકબીજા સાથે જોડાયેલા હોય છે અને એક સુંદર સ્ફટિક જાળી બનાવે છે. પરંતુ તે તદ્દન અસ્થિર છે અને સરળતાથી વિભાજિત થઈ શકે છે, ઓગળી શકે છે, એટલે કે, વિકૃત થઈ શકે છે. અણુઓ વચ્ચે ઘણી ખાલી જગ્યાઓ છે, જેનાં પરિમાણો કણોના પરિમાણો કરતાં વધી જાય છે. આ કારણે, બરફની ઘનતા પ્રવાહી હાઇડ્રોજન ઓક્સાઇડ કરતાં ઓછી છે.

નદીઓ, સરોવરો અને અન્ય તાજા જળ સંસ્થાઓ માટે આનું ખૂબ મહત્વ છે. ખરેખર, શિયાળામાં, તેમાંનું પાણી સંપૂર્ણપણે સ્થિર થતું નથી, પરંતુ તે ફક્ત હળવા બરફના ગાઢ પોપડાથી ઢંકાયેલું હોય છે જે ટોચ પર તરતું હોય છે. જો આ ગુણધર્મ હાઇડ્રોજન ઓક્સાઇડની નક્કર સ્થિતિની લાક્ષણિકતા ન હોત, તો જળાશયો સ્થિર થઈ જશે. પાણી હેઠળ જીવન અશક્ય હશે.
વધુમાં, તાજા પીવાના પાણીના વિશાળ જથ્થાના સ્ત્રોત તરીકે પાણીની નક્કર સ્થિતિનું ખૂબ મહત્વ છે. આ હિમનદીઓ છે.
પાણીની વિશેષ મિલકતને ત્રિબિંદુ ઘટના કહી શકાય. આ એક એવી સ્થિતિ છે જેમાં બરફ, વરાળ અને પ્રવાહી એકસાથે અસ્તિત્વમાં હોઈ શકે છે. આને નીચેની શરતોની જરૂર છે:
- ઉચ્ચ દબાણ - 610 Pa;
- તાપમાન 0.01 0 સે.
પાણીની સ્પષ્ટતા વિદેશી બાબતોના આધારે બદલાય છે. પ્રવાહી સંપૂર્ણપણે પારદર્શક, અપારદર્શક અથવા વાદળછાયું હોઈ શકે છે. પીળા અને લાલ રંગના તરંગો શોષાય છે, વાયોલેટ કિરણો ઊંડે ઘૂસી જાય છે.

રાસાયણિક ગુણધર્મો
પાણી અને તેના ગુણધર્મો જીવનની ઘણી પ્રક્રિયાઓને સમજવા માટે એક મહત્વપૂર્ણ સાધન છે. તેથી તેઓ ખૂબ સારી રીતે અભ્યાસ કરવામાં આવ્યા છે. આમ, હાઇડ્રોકેમિસ્ટ્રી પાણી અને તેના રાસાયણિક ગુણધર્મોમાં રસ ધરાવે છે. તેમાંથી નીચેના છે:
- કઠોરતા. આ એક એવી મિલકત છે જે કેલ્શિયમ અને મેગ્નેશિયમ ક્ષારની હાજરી અને ઉકેલમાં તેમના આયન દ્વારા સમજાવવામાં આવે છે. તે કાયમી (નામિત ધાતુઓના ક્ષાર: ક્લોરાઇડ્સ, સલ્ફેટ્સ, સલ્ફાઇટ્સ, નાઈટ્રેટ્સ), અસ્થાયી (બાયકાર્બોનેટ) માં વહેંચાયેલું છે, જે ઉકાળવાથી દૂર થાય છે. રશિયામાં, સારી ગુણવત્તા માટે ઉપયોગ કરતા પહેલા પાણીને રાસાયણિક રીતે નરમ કરવામાં આવે છે.
- ખનિજીકરણ. હાઇડ્રોજન ઓક્સાઇડના દ્વિધ્રુવ ક્ષણ પર આધારિત મિલકત. તેની હાજરી માટે આભાર, પરમાણુઓ અન્ય ઘણા પદાર્થો, આયનોને પોતાની સાથે જોડવામાં અને તેમને પકડી રાખવા સક્ષમ છે. આ રીતે સહયોગીઓ, ક્લેથ્રેટ્સ અને અન્ય સંગઠનો રચાય છે.
- રેડોક્સ ગુણધર્મો. સાર્વત્રિક દ્રાવક, ઉત્પ્રેરક અને સહયોગી તરીકે, પાણી ઘણા સરળ અને જટિલ સંયોજનો સાથે ક્રિયાપ્રતિક્રિયા કરવામાં સક્ષમ છે. કેટલાક સાથે તે ઓક્સિડાઇઝિંગ એજન્ટ તરીકે કામ કરે છે, અન્ય સાથે - ઊલટું. ઘટાડતા એજન્ટ તરીકે તે હેલોજન, ક્ષાર, કેટલીક ઓછી સક્રિય ધાતુઓ અને ઘણા કાર્બનિક પદાર્થો સાથે પ્રતિક્રિયા આપે છે. કાર્બનિક રસાયણશાસ્ત્ર નવીનતમ પરિવર્તનનો અભ્યાસ કરે છે. પાણી અને તેના ગુણધર્મો, ખાસ કરીને રાસાયણિક, દર્શાવે છે કે તે કેટલું સાર્વત્રિક અને અનન્ય છે. ઓક્સિડાઇઝિંગ એજન્ટ તરીકે, તે સક્રિય ધાતુઓ, કેટલાક દ્વિસંગી ક્ષાર, ઘણા કાર્બનિક સંયોજનો, કાર્બન અને મિથેન સાથે પ્રતિક્રિયા આપે છે. સામાન્ય રીતે, આપેલ પદાર્થને સંડોવતા રાસાયણિક પ્રતિક્રિયાઓને અમુક શરતોની પસંદગીની જરૂર હોય છે. પ્રતિક્રિયાનું પરિણામ તેમના પર નિર્ભર રહેશે.
- બાયોકેમિકલ ગુણધર્મો. પાણી એ દ્રાવક, ઉત્પ્રેરક અને માધ્યમ હોવાને કારણે શરીરની તમામ બાયોકેમિકલ પ્રક્રિયાઓનો અભિન્ન ભાગ છે.
- ક્લેથ્રેટ્સ બનાવવા માટે વાયુઓ સાથે ક્રિયાપ્રતિક્રિયા. સામાન્ય પ્રવાહી પાણી રાસાયણિક રીતે નિષ્ક્રિય વાયુઓને પણ શોષી શકે છે અને તેને આંતરિક રચનાના પરમાણુઓ વચ્ચેના પોલાણમાં મૂકી શકે છે. આવા સંયોજનોને સામાન્ય રીતે ક્લેથ્રેટ્સ કહેવામાં આવે છે.
- ઘણી ધાતુઓ સાથે, હાઇડ્રોજન ઓક્સાઇડ સ્ફટિકીય હાઇડ્રેટ બનાવે છે, જેમાં તે અપરિવર્તિત શામેલ છે. ઉદાહરણ તરીકે, કોપર સલ્ફેટ (CuSO 4 * 5H 2 O), તેમજ સામાન્ય હાઇડ્રેટ (NaOH * H 2 O અને અન્ય).
- પાણી સંયોજન પ્રતિક્રિયાઓ દ્વારા વર્ગીકૃત થયેલ છે જેમાં પદાર્થોના નવા વર્ગો (એસિડ, આલ્કલી, પાયા) રચાય છે. તેઓ રેડોક્સ નથી.
- ઇલેક્ટ્રોલિસિસ. ઇલેક્ટ્રિક પ્રવાહના પ્રભાવ હેઠળ, પરમાણુ તેના ઘટક વાયુઓમાં વિઘટન કરે છે - હાઇડ્રોજન અને ઓક્સિજન. તેમને મેળવવાની એક રીત પ્રયોગશાળા અને ઉદ્યોગમાં છે.
લેવિસના સિદ્ધાંતના દૃષ્ટિકોણથી, પાણી એ એક જ સમયે નબળા એસિડ અને નબળા આધાર છે (એમ્ફોલાઇટ). એટલે કે, આપણે રાસાયણિક ગુણધર્મોમાં ચોક્કસ એમ્ફોટેરિસિટી વિશે વાત કરી શકીએ છીએ.

જીવંત પ્રાણીઓ માટે પાણી અને તેના ફાયદાકારક ગુણધર્મો
હાઈડ્રોજન ઑકસાઈડનું તમામ જીવો માટે મહત્ત્વનું મૂલ્યાંકન કરવું મુશ્કેલ છે. છેવટે, પાણી એ જીવનનો સ્ત્રોત છે. તે જાણીતું છે કે તેના વિના વ્યક્તિ એક અઠવાડિયા પણ જીવી શકતો નથી. પાણી, તેના ગુણધર્મો અને મહત્વ ફક્ત પ્રચંડ છે.
- તે એક સાર્વત્રિક દ્રાવક છે, એટલે કે, જીવંત પ્રણાલીઓમાં કાર્ય કરીને, કાર્બનિક અને અકાર્બનિક સંયોજનોને વિસર્જન કરવામાં સક્ષમ છે. તેથી જ જટિલ મહત્વપૂર્ણ જટિલ સંયોજનોની રચના સાથે, તમામ ઉત્પ્રેરક બાયોકેમિકલ પરિવર્તનો માટે પાણી એ સ્ત્રોત અને માધ્યમ છે.
- હાઇડ્રોજન બોન્ડ બનાવવાની ક્ષમતા આ પદાર્થને તેની એકત્રીકરણની સ્થિતિ બદલ્યા વિના તાપમાનનો સામનો કરવા માટે સાર્વત્રિક બનાવે છે. જો આવું ન હોત, તો પછી ડિગ્રીમાં સહેજ ઘટાડો સાથે તે જીવંત પ્રાણીઓની અંદર બરફમાં ફેરવાઈ જશે, જેના કારણે કોષ મૃત્યુ થશે.
- મનુષ્યો માટે, પાણી એ તમામ મૂળભૂત ઘરગથ્થુ ચીજવસ્તુઓ અને જરૂરિયાતોનો સ્ત્રોત છે: રસોઈ, ધોવા, સફાઈ, સ્નાન, સ્નાન અને તરવું વગેરે.
- ઔદ્યોગિક પ્લાન્ટ્સ (કેમિકલ, ટેક્સટાઇલ, એન્જિનિયરિંગ, ફૂડ, ઓઇલ રિફાઇનિંગ અને અન્ય) હાઇડ્રોજન ઑકસાઈડની ભાગીદારી વિના તેમનું કાર્ય કરી શકશે નહીં.
- પ્રાચીન સમયથી એવું માનવામાં આવતું હતું કે પાણી આરોગ્યનો સ્ત્રોત છે. તે ઔષધીય પદાર્થ તરીકે આજે પણ ઉપયોગમાં લેવાય છે.
- છોડ તેનો ઉપયોગ પોષણના તેમના મુખ્ય સ્ત્રોત તરીકે કરે છે, જેના કારણે તેઓ ઓક્સિજન ઉત્પન્ન કરે છે, જે ગેસ આપણા ગ્રહ પર જીવન અસ્તિત્વમાં રહેવા દે છે.
તમામ જીવંત અને કૃત્રિમ રીતે બનાવેલી વસ્તુઓ માટે પાણી એ સૌથી વધુ વ્યાપક, મહત્વપૂર્ણ અને જરૂરી પદાર્થ કેમ છે તેના ડઝનેક વધુ કારણોને આપણે નામ આપી શકીએ છીએ. અમે ફક્ત સૌથી સ્પષ્ટ, મુખ્ય મુદ્દાઓ ટાંક્યા છે.

પાણીનું હાઇડ્રોલોજિકલ ચક્ર
બીજા શબ્દોમાં કહીએ તો, આ પ્રકૃતિમાં તેનું ચક્ર છે. એક ખૂબ જ મહત્વપૂર્ણ પ્રક્રિયા જે અમને સતત ઘટતા પાણીના પુરવઠાને ફરીથી ભરવાની મંજૂરી આપે છે. તે કેવી રીતે થાય છે?
ત્યાં ત્રણ મુખ્ય સહભાગીઓ છે: ભૂગર્ભ (અથવા ભૂગર્ભજળ) પાણી, સપાટીનું પાણી અને વિશ્વ મહાસાગર. વાતાવરણ, જે ઘનીકરણ કરે છે અને વરસાદ ઉત્પન્ન કરે છે, તે પણ મહત્વપૂર્ણ છે. આ પ્રક્રિયામાં સક્રિય સહભાગીઓ પણ છોડ (મુખ્યત્વે વૃક્ષો) છે, જે દરરોજ મોટા પ્રમાણમાં પાણી શોષી લેવામાં સક્ષમ છે.
તેથી, પ્રક્રિયા નીચે પ્રમાણે ચાલે છે. ભૂગર્ભજળ ભૂગર્ભ રુધિરકેશિકાઓ ભરે છે અને સપાટી અને વિશ્વ મહાસાગરમાં વહે છે. પછી સપાટીનું પાણી છોડ દ્વારા શોષાય છે અને પર્યાવરણમાં પ્રસારિત થાય છે. મહાસાગરો, સમુદ્રો, નદીઓ, સરોવરો અને અન્ય જળાશયોના વિશાળ વિસ્તારોમાંથી પણ બાષ્પીભવન થાય છે. એકવાર વાતાવરણમાં, પાણી શું કરે છે? તે ઘટ્ટ થાય છે અને વરસાદ (વરસાદ, બરફ, કરા) ના રૂપમાં પાછો વહે છે.
જો આ પ્રક્રિયાઓ ન થઈ હોત, તો પાણીનો પુરવઠો, ખાસ કરીને તાજું પાણી, લાંબા સમય પહેલા સમાપ્ત થઈ ગયું હોત. એટલા માટે લોકો રક્ષણ અને સામાન્ય હાઇડ્રોલોજિકલ ચક્ર પર ખૂબ ધ્યાન આપે છે.
ભારે પાણીનો ખ્યાલ
પ્રકૃતિમાં, હાઇડ્રોજન ઓક્સાઇડ આઇસોટોપોલોગ્સના મિશ્રણ તરીકે અસ્તિત્વમાં છે. આ એ હકીકતને કારણે છે કે હાઇડ્રોજન ત્રણ પ્રકારના આઇસોટોપ બનાવે છે: પ્રોટિયમ 1 એચ, ડ્યુટેરિયમ 2 એચ, ટ્રીટિયમ 3 એચ. ઓક્સિજન, બદલામાં, પણ પાછળ રહેતો નથી અને ત્રણ સ્થિર સ્વરૂપો બનાવે છે: 16 O, 17 O, 18 O તેથી, H 2 O (1 H અને 16 O) નું સામાન્ય પ્રોટિયમ પાણી નથી, પણ ડ્યુટેરિયમ અને ટ્રીટિયમ પણ છે.

તે જ સમયે, તે ડ્યુટેરિયમ (2 એચ) છે જે બંધારણ અને સ્વરૂપમાં સ્થિર છે, જે લગભગ તમામ કુદરતી પાણીની રચનામાં શામેલ છે, પરંતુ ઓછી માત્રામાં. આને તેઓ ભારે કહે છે. તે બધી બાબતોમાં સામાન્ય અથવા પ્રકાશથી કંઈક અંશે અલગ છે.
ભારે પાણી અને તેના ગુણધર્મો કેટલાક બિંદુઓ દ્વારા વર્ગીકૃત થયેલ છે.
- 3.82 0 સે તાપમાને સ્ફટિકીકરણ થાય છે.
- ઉકળતા 101.42 0 સે. પર જોવા મળે છે.
- ઘનતા 1.1059 g/cm3 છે.
- દ્રાવક તરીકે તે હળવા પાણી કરતાં અનેક ગણું ખરાબ છે.
- તેમાં રાસાયણિક સૂત્ર D 2 O છે.
જીવંત પ્રણાલીઓ પર આવા પાણીના પ્રભાવને દર્શાવતા પ્રયોગો હાથ ધરવા પર, તે જાણવા મળ્યું કે માત્ર કેટલાક પ્રકારના બેક્ટેરિયા તેમાં રહેવા માટે સક્ષમ છે. વસાહતોને અનુકૂલન અને અનુકૂળ થવામાં સમય લાગ્યો. પરંતુ, અનુકૂલન કર્યા પછી, તેઓએ તમામ મહત્વપૂર્ણ કાર્યો (પ્રજનન, પોષણ) ને સંપૂર્ણપણે પુનઃસ્થાપિત કર્યા. વધુમાં, સ્ટીલ રેડિયેશન માટે ખૂબ પ્રતિરોધક છે. દેડકા અને માછલી પરના પ્રયોગોએ સકારાત્મક પરિણામ આપ્યું નથી.
ડ્યુટેરિયમના ઉપયોગના આધુનિક ક્ષેત્રો અને તેના દ્વારા રચાયેલ ભારે પાણી પરમાણુ અને પરમાણુ ઊર્જા છે. આવા પાણી સામાન્ય વિદ્યુત વિચ્છેદન-વિશ્લેષણનો ઉપયોગ કરીને પ્રયોગશાળાની પરિસ્થિતિઓમાં મેળવી શકાય છે - તે આડપેદાશ તરીકે રચાય છે. ખાસ ઉપકરણોમાં હાઇડ્રોજનના પુનરાવર્તિત નિસ્યંદન દરમિયાન ડ્યુટેરિયમ પોતે જ રચાય છે. તેનો ઉપયોગ ન્યુટ્રોન ફ્યુઝન અને પ્રોટોન પ્રતિક્રિયાઓને ધીમું કરવાની તેની ક્ષમતા પર આધારિત છે. તે ભારે પાણી અને હાઇડ્રોજન આઇસોટોપ્સ છે જે પરમાણુ અને હાઇડ્રોજન બોમ્બ બનાવવા માટેનો આધાર છે.
ઓછી માત્રામાં લોકો દ્વારા ડ્યુટેરિયમ પાણીના ઉપયોગ પરના પ્રયોગો દર્શાવે છે કે તે લાંબા સમય સુધી ટકી શકતું નથી - બે અઠવાડિયા પછી સંપૂર્ણ ઉપાડ જોવા મળે છે. તેનો ઉપયોગ જીવન માટે ભેજના સ્ત્રોત તરીકે કરી શકાતો નથી, પરંતુ તેનું તકનીકી મહત્વ ફક્ત પ્રચંડ છે.
ઓગળેલું પાણી અને તેનો ઉપયોગ
પ્રાચીન કાળથી, આવા પાણીના ગુણધર્મોને લોકો દ્વારા હીલિંગ તરીકે ઓળખવામાં આવે છે. તે લાંબા સમયથી નોંધવામાં આવ્યું છે કે જ્યારે બરફ પીગળે છે, ત્યારે પ્રાણીઓ પરિણામી ખાબોચિયામાંથી પાણી પીવાનો પ્રયાસ કરે છે. પાછળથી, તેની રચના અને માનવ શરીર પર જૈવિક અસરોનો કાળજીપૂર્વક અભ્યાસ કરવામાં આવ્યો.

ઓગળતું પાણી, તેની લાક્ષણિકતાઓ અને ગુણધર્મો સામાન્ય હળવા પાણી અને બરફની વચ્ચે છે. અંદરથી, તે માત્ર અણુઓ દ્વારા જ નહીં, પરંતુ સ્ફટિકો અને ગેસ દ્વારા રચાયેલા ક્લસ્ટરોના સમૂહ દ્વારા રચાય છે. એટલે કે, સ્ફટિકના માળખાકીય ભાગો વચ્ચેના ખાલીપોની અંદર હાઇડ્રોજન અને ઓક્સિજન હોય છે. સામાન્ય રીતે, ઓગળેલા પાણીની રચના બરફની રચના જેવી જ હોય છે - રચના સચવાય છે. આવા હાઇડ્રોજન ઓક્સાઇડના ભૌતિક ગુણધર્મો પરંપરાગત લોકોની તુલનામાં સહેજ બદલાય છે. જો કે, શરીર પર જૈવિક અસર ઉત્તમ છે.
જ્યારે પાણી સ્થિર થાય છે, ત્યારે પ્રથમ અપૂર્ણાંક ભારે ભાગ બરફમાં ફેરવાય છે - આ ડ્યુટેરિયમ આઇસોટોપ્સ, ક્ષાર અને અશુદ્ધિઓ છે. તેથી, આ કોરને દૂર કરવું જોઈએ. પરંતુ બાકીનું સ્વચ્છ, સંરચિત અને સ્વસ્થ પાણી છે. શરીર પર શું અસર થાય છે? ડોનેટ્સ્ક સંશોધન સંસ્થાના વૈજ્ઞાનિકોએ નીચેના પ્રકારનાં સુધારાઓને નામ આપ્યું છે:
- પુનઃપ્રાપ્તિ પ્રક્રિયાઓનું પ્રવેગક.
- રોગપ્રતિકારક તંત્રને મજબૂત બનાવવું.
- બાળકોમાં આ પાણી શ્વાસમાં લેવાથી શરદી પુનઃસ્થાપિત થાય છે અને મટે છે, ખાંસી, વહેતું નાક વગેરે દૂર થાય છે.
- શ્વાસ, કંઠસ્થાન અને મ્યુકોસ મેમ્બ્રેનની સ્થિતિ સુધરે છે.
- વ્યક્તિની સામાન્ય સુખાકારી અને પ્રવૃત્તિ વધે છે.
આજે ઓગળેલા પાણી સાથે સારવારના ઘણા સમર્થકો છે જેઓ તેમની સકારાત્મક સમીક્ષાઓ લખે છે. જો કે, ડોકટરો સહિતના વૈજ્ઞાનિકો છે, જેઓ આ મંતવ્યોને સમર્થન આપતા નથી. તેઓ માને છે કે આવા પાણીથી કોઈ નુકસાન થશે નહીં, પરંતુ થોડો ફાયદો પણ થશે.
ઉર્જા
એકત્રીકરણના વિવિધ રાજ્યોમાં સંક્રમણ કરતી વખતે પાણીના ગુણધર્મો કેમ બદલાઈ શકે છે અને પુનઃસ્થાપિત કરી શકાય છે? આ પ્રશ્નનો જવાબ નીચે મુજબ છે: આ સંયોજનની પોતાની માહિતી મેમરી છે, જે તમામ ફેરફારોને રેકોર્ડ કરે છે અને યોગ્ય સમયે બંધારણ અને ગુણધર્મોને પુનઃસ્થાપિત કરવા તરફ દોરી જાય છે. બાયોએનર્જી ક્ષેત્ર જેમાંથી પાણીનો ભાગ પસાર થાય છે (જે અવકાશમાંથી આવે છે) તે ઊર્જાનો શક્તિશાળી ચાર્જ વહન કરે છે. આ પેટર્નનો ઉપયોગ ઘણીવાર સારવારમાં થાય છે. જો કે, તબીબી દૃષ્ટિકોણથી, દરેક પાણીમાં માહિતી સહિત ફાયદાકારક અસર થઈ શકે નહીં.
સંરચિત પાણી - તે શું છે?
આ પાણી છે જે પરમાણુઓની થોડી અલગ રચના ધરાવે છે, સ્ફટિક જાળીની ગોઠવણી (બરફમાં જોવા મળે છે તે જ), પરંતુ તે હજી પણ પ્રવાહી છે (ઓગળવું પણ આ પ્રકારનું છે). આ કિસ્સામાં, પાણીની રચના અને તેના ગુણધર્મો, વૈજ્ઞાનિક દૃષ્ટિકોણથી, સામાન્ય હાઇડ્રોજન ઓક્સાઇડની લાક્ષણિકતાથી અલગ નથી. તેથી, સંરચિત પાણીમાં આટલી વ્યાપક હીલિંગ અસર હોઈ શકતી નથી કે વૈકલ્પિક દવાના સમર્થકો અને વૈકલ્પિક દવાના સમર્થકો તેને આભારી છે.
મુખ્ય પદાર્થ જે ગ્રહ પર જીવનને અસ્તિત્વમાં રહેવા દે છે તે પાણી છે. તે કોઈપણ સ્થિતિમાં જરૂરી છે. પ્રવાહીના ગુણધર્મોના અભ્યાસથી સમગ્ર વિજ્ઞાન - હાઇડ્રોલોજીની રચના થઈ. મોટાભાગના વૈજ્ઞાનિકોના અભ્યાસનો વિષય છે ભૌતિક અને રાસાયણિક ગુણધર્મો. તેઓ આ ગુણધર્મો દ્વારા સમજે છે: નિર્ણાયક તાપમાન, સ્ફટિક જાળી, અશુદ્ધિઓ અને રાસાયણિક સંયોજનની અન્ય વ્યક્તિગત લાક્ષણિકતાઓ.
ના સંપર્કમાં છે
અભ્યાસ કરે છે
પાણીનું સૂત્રદરેક શાળાના બાળકો માટે જાણીતું છે. આ ત્રણ સરળ ચિહ્નો છે, પરંતુ તે ગ્રહ પરની દરેક વસ્તુના કુલ સમૂહના 75% માં સમાયેલ છે.
H2O- આ બે અણુઓ અને એક છે. પરમાણુની રચનામાં પ્રયોગમૂલક સ્વરૂપ છે, તેથી જ પ્રવાહીના ગુણધર્મો તેની સરળ રચના હોવા છતાં, ખૂબ જ વૈવિધ્યસભર છે. દરેક પરમાણુ પડોશીઓથી ઘેરાયેલા છે. તેઓ એક સ્ફટિક જાળી દ્વારા જોડાયેલા છે.
રચનાની સરળતાએકત્રીકરણના વિવિધ રાજ્યોમાં પ્રવાહીને અસ્તિત્વમાં રહેવાની મંજૂરી આપે છે. ગ્રહ પરનો એક પણ પદાર્થ આની બડાઈ કરી શકતો નથી. H2O ખૂબ જ મોબાઇલ છે; આ મિલકતમાં તે હવા પછી બીજા ક્રમે છે. જળચક્ર વિશે દરેક વ્યક્તિ વાકેફ છે કે તે પૃથ્વીની સપાટી પરથી બાષ્પીભવન થઈ જાય પછી દૂર ક્યાંક વરસાદ કે બરફ પડે છે. આબોહવા નિયંત્રિતચોક્કસપણે પ્રવાહીના ગુણધર્મોને લીધે, જે ગરમી આપી શકે છે, જ્યારે પોતે વ્યવહારીક રીતે તેનું તાપમાન બદલતું નથી.
ભૌતિક ગુણધર્મો
H2O અને તેના ગુણધર્મોઘણા મુખ્ય પરિબળો પર આધાર રાખે છે. મુખ્ય રાશિઓ:
- ક્રિસ્ટલ સેલ. પાણીની રચના, અથવા તેના બદલે તેની સ્ફટિક જાળી, તેના એકત્રીકરણની સ્થિતિ દ્વારા નક્કી કરવામાં આવે છે. તે એક છૂટક પરંતુ ખૂબ મજબૂત માળખું ધરાવે છે. સ્નોવફ્લેક્સ નક્કર સ્થિતિમાં જાળી દર્શાવે છે, પરંતુ સામાન્ય પ્રવાહી સ્થિતિમાં, પાણી તેના સ્ફટિકોની રચનામાં સ્પષ્ટતા નથી, તે મોબાઇલ અને પરિવર્તનશીલ છે.
- પરમાણુનું માળખું એક ગોળ છે. પરંતુ ગુરુત્વાકર્ષણના પ્રભાવને કારણે પાણી તે જહાજનો આકાર લે છે જેમાં તે સ્થિત છે. અવકાશમાં તે આકારમાં ભૌમિતિક રીતે યોગ્ય હશે.
- પાણી અન્ય પદાર્થો સાથે પ્રતિક્રિયા આપે છે, જેમાં આલ્કોહોલ અને એમોનિયા સહિતના ઈલેક્ટ્રોનની જોડી ન હોય તેવા પદાર્થોનો સમાવેશ થાય છે.
- ઉચ્ચ ગરમી ક્ષમતા અને થર્મલ વાહકતા છે, ઝડપથી ગરમ થાય છે અને લાંબા સમય સુધી ઠંડુ થતું નથી.
- તે શાળાના સમયથી જાણીતું છે કે ઉત્કલન બિંદુ 100 ડિગ્રી સેલ્સિયસ છે. જ્યારે તે +4 ડિગ્રી સુધી ઘટી જાય ત્યારે પ્રવાહીમાં સ્ફટિકો દેખાય છે, પરંતુ તેનાથી પણ વધુ ઘટાડા પર બરફ રચાય છે. ઉત્કલન બિંદુ એ દબાણ પર આધાર રાખે છે કે જેના હેઠળ H2O મૂકવામાં આવે છે. એક પ્રયોગ છે જેમાં રાસાયણિક સંયોજનનું તાપમાન 300 ડિગ્રી સુધી પહોંચે છે, અને પ્રવાહી ઉકળતું નથી, પરંતુ સીસું ઓગળે છે.
- અન્ય મહત્વની મિલકત સપાટી તણાવ છે. પાણીનું સૂત્ર તેને ખૂબ ટકાઉ રહેવા દે છે. વૈજ્ઞાનિકોએ શોધી કાઢ્યું છે કે તેને તોડવા માટે, 100 ટનથી વધુ વજનવાળા બળની જરૂર પડશે.
રસપ્રદ! H2O, અશુદ્ધિઓથી શુદ્ધ (નિસ્યંદિત), વર્તમાનનું સંચાલન કરી શકતું નથી. હાઇડ્રોજન ઓક્સાઇડની આ મિલકત માત્ર તેમાં ઓગળેલા ક્ષારની હાજરીમાં જ દેખાય છે.
બીજી સુવિધાઓ
બરફ છે અનન્ય સ્થિતિ,જે હાઇડ્રોજન ઓક્સાઇડની લાક્ષણિકતા છે. તે છૂટક બોન્ડ બનાવે છે જે સરળતાથી વિકૃત થઈ જાય છે. વધુમાં, કણો વચ્ચેનું અંતર નોંધપાત્ર રીતે વધે છે, જે બરફની ઘનતા પ્રવાહી કરતાં ઘણી ઓછી બનાવે છે. આનાથી જળાશયો શિયાળામાં સંપૂર્ણપણે થીજી ન જાય, બરફના સ્તર હેઠળ જીવન જાળવી રાખે છે. ગ્લેશિયર્સ એ તાજા પાણીનો મોટો પુરવઠો છે.
રસપ્રદ! H2O ની એક અનોખી સ્થિતિ છે જેને ટ્રિપલ પોઈન્ટ ઘટના કહેવાય છે. આ તે છે જ્યારે તેણી એક સાથે તેના ત્રણ રાજ્યોમાં હોય છે. આ સ્થિતિ ફક્ત 0.01 ડિગ્રી તાપમાન અને 610 Pa ના દબાણ પર જ શક્ય છે.
રાસાયણિક ગુણધર્મો
મૂળભૂત રાસાયણિક ગુણધર્મો:
- પાણીને કઠિનતા અનુસાર, નરમ અને મધ્યમથી સખત સુધી વિભાજિત કરવામાં આવે છે. આ સૂચક ઉકેલમાં મેગ્નેશિયમ અને પોટેશિયમ ક્ષારની સામગ્રી પર આધાર રાખે છે. એવા પણ છે જે સતત પ્રવાહીમાં હોય છે, અને કેટલાકને ઉકાળીને છુટકારો મેળવી શકાય છે.
- ઓક્સિડેશન અને ઘટાડો. H2O રસાયણશાસ્ત્રમાં અભ્યાસ કરાયેલી પ્રક્રિયાઓને અસર કરે છે જે અન્ય પદાર્થો સાથે થાય છે: તે કેટલાક ઓગળે છે અને અન્ય સાથે પ્રતિક્રિયા આપે છે. કોઈપણ પ્રયોગનું પરિણામ તે કઈ પરિસ્થિતિઓમાં થાય છે તેની યોગ્ય પસંદગી પર આધાર રાખે છે.
- બાયોકેમિકલ પ્રક્રિયાઓ પર પ્રભાવ. પાણી કોઈપણ કોષનો મુખ્ય ભાગ, તેમાં, પર્યાવરણની જેમ, શરીરમાં બધી પ્રતિક્રિયાઓ થાય છે.
- પ્રવાહી સ્થિતિમાં, તે નિષ્ક્રિય વાયુઓને શોષી લે છે. તેમના પરમાણુઓ પોલાણની અંદર H2O અણુઓ વચ્ચે સ્થિત છે. આ રીતે ક્લેથ્રેટ્સ રચાય છે.
- હાઇડ્રોજન ઓક્સાઇડની મદદથી, નવા પદાર્થો રચાય છે જે રેડોક્સ પ્રક્રિયા સાથે સંકળાયેલા નથી. અમે આલ્કલી, એસિડ અને પાયા વિશે વાત કરી રહ્યા છીએ.
- પાણીની બીજી લાક્ષણિકતા એ સ્ફટિકીય હાઇડ્રેટ બનાવવાની ક્ષમતા છે. હાઇડ્રોજન ઓક્સાઇડ યથાવત રહે છે. સામાન્ય હાઇડ્રેટ્સમાં, કોપર સલ્ફેટને ઓળખી શકાય છે.
- જો કનેક્શનમાંથી ઇલેક્ટ્રિક પ્રવાહ પસાર થાય છે, તો પછી પરમાણુ વાયુઓમાં ભાંગી શકાય છે.

વ્યક્તિ માટે મહત્વ
ઘણા લાંબા સમય પહેલા, લોકોને તમામ જીવંત વસ્તુઓ અને સમગ્ર ગ્રહ માટે પ્રવાહીનું અમૂલ્ય મહત્વ સમજાયું હતું. . તેના વિના વ્યક્તિ જીવી શકતી નથીઅને અઠવાડિયા . પૃથ્વી પરના આ સૌથી સામાન્ય પદાર્થની ફાયદાકારક અસર શું છે?
- સૌથી મહત્વપૂર્ણ એપ્લિકેશન એ શરીરમાં તેની હાજરી છે, કોષોમાં જ્યાં તમામ સૌથી મહત્વપૂર્ણ પ્રતિક્રિયાઓ થાય છે.
- હાઇડ્રોજન બોન્ડની રચના જીવંત પ્રાણીઓ પર ફાયદાકારક અસર કરે છે, કારણ કે જ્યારે તાપમાનમાં ફેરફાર થાય છે, ત્યારે શરીરમાં પ્રવાહી સ્થિર થતું નથી.
- લોકો લાંબા સમયથી રોજિંદા જરૂરિયાતો માટે H2O નો ઉપયોગ કરી રહ્યા છે, રસોઈ ઉપરાંત, ધોવા, સફાઈ, નાહવા.
- કોઈપણ ઔદ્યોગિક પ્લાન્ટ પ્રવાહી વિના કામ કરી શકતો નથી.
- H2O - જીવન અને આરોગ્યનો સ્ત્રોત, તેણી દવા છે.
- છોડ તેના વિકાસ અને જીવનના તમામ તબક્કે તેનો ઉપયોગ કરે છે. તેની મદદથી, તેઓ ઓક્સિજન ઉત્પન્ન કરે છે, જે જીવંત પ્રાણીઓના જીવન માટે જરૂરી ગેસ છે.
સૌથી સ્પષ્ટ ફાયદાકારક ગુણધર્મો ઉપરાંત, ત્યાં ઘણા વધુ છે.

મનુષ્ય માટે પાણીનું મહત્વ
જટિલ તાપમાન
H2O, બધા પદાર્થોની જેમ, તાપમાન ધરાવે છે, જે જટિલ કહેવાય છે. પાણીનું નિર્ણાયક તાપમાન તેને ગરમ કરવાની પદ્ધતિ દ્વારા નક્કી કરવામાં આવે છે. 374 ડિગ્રી સેલ્સિયસ સુધી, પ્રવાહીને વરાળ કહેવામાં આવે છે; તે હજી પણ ચોક્કસ દબાણ પર તેની સામાન્ય પ્રવાહી સ્થિતિમાં ફરી શકે છે. જ્યારે તાપમાન આ નિર્ણાયક બિંદુથી ઉપર હોય છે, ત્યારે પાણી, રાસાયણિક તત્વ તરીકે, અફર રીતે ગેસમાં ફેરવાય છે.
રસાયણશાસ્ત્રમાં અરજી
H2O તેની મુખ્ય મિલકત - ઓગળવાની ક્ષમતાને કારણે રસાયણશાસ્ત્રીઓ માટે ખૂબ રસ ધરાવે છે. વૈજ્ઞાનિકો ઘણીવાર તેનો ઉપયોગ પદાર્થોને શુદ્ધ કરવા માટે કરે છે, ત્યાં પ્રયોગો કરવા માટે અનુકૂળ પરિસ્થિતિઓ બનાવે છે. ઘણા કિસ્સાઓમાં તે એક પર્યાવરણ પૂરું પાડે છે જેમાં પાઇલોટ પરીક્ષણ હાથ ધરવામાં આવે છે. વધુમાં, H2O પોતે રાસાયણિક પ્રક્રિયાઓમાં ભાગ લે છે, એક અથવા બીજા રાસાયણિક પ્રયોગને પ્રભાવિત કરે છે. તે બિન-ધાતુ અને ધાતુના પદાર્થો સાથે જોડાય છે.
ત્રણ રાજ્યો
 માં લોકોને પાણી દેખાય છે ત્રણ રાજ્યો,એગ્રીગેટ્સ કહેવાય છે. આ પ્રવાહી, બરફ અને ગેસ છે. પદાર્થ રચનામાં સમાન છે, પરંતુ ગુણધર્મોમાં અલગ છે. યુ
માં લોકોને પાણી દેખાય છે ત્રણ રાજ્યો,એગ્રીગેટ્સ કહેવાય છે. આ પ્રવાહી, બરફ અને ગેસ છે. પદાર્થ રચનામાં સમાન છે, પરંતુ ગુણધર્મોમાં અલગ છે. યુ
પુનર્જન્મ કરવાની ક્ષમતા એ સમગ્ર ગ્રહ માટે પાણીની ખૂબ જ મહત્વપૂર્ણ લાક્ષણિકતા છે, આમ તેનું પરિભ્રમણ થાય છે.
ત્રણેય અવસ્થાઓની સરખામણી કરતા, વ્યક્તિ રાસાયણિક સંયોજનને પ્રવાહી સ્વરૂપમાં વધુ વખત જુએ છે. પાણીને કોઈ સ્વાદ કે ગંધ હોતી નથી, અને તેમાં જે અનુભવાય છે તે અશુદ્ધિઓ, તેમાં ઓગળેલા પદાર્થોની હાજરીને કારણે છે.
પ્રવાહી સ્થિતિમાં પાણીના મુખ્ય ગુણધર્મો છે: પ્રચંડ શક્તિ, જે તમને પત્થરોને તીક્ષ્ણ બનાવવા અને ખડકોનો નાશ કરવા તેમજ કોઈપણ આકાર લેવાની ક્ષમતા આપે છે.
જ્યારે નાના કણો સ્થિર થાય છે, ત્યારે તેઓ તેમની ઝડપ ઘટાડે છે અને તેમનું અંતર વધારે છે, તેથી બરફનું માળખું છિદ્રાળુ છેઅને પ્રવાહી કરતાં ઓછી ઘનતા. વિવિધ ઘરગથ્થુ અને ઔદ્યોગિક હેતુઓ માટે રેફ્રિજરેશન એકમોમાં બરફનો ઉપયોગ થાય છે. પ્રકૃતિમાં, બરફ ફક્ત વિનાશનું કારણ બને છે, કરા અથવા હિમપ્રપાતના રૂપમાં પડવું.
ગેસ એ બીજી સ્થિતિ છે જે જ્યારે પાણીના નિર્ણાયક તાપમાન સુધી પહોંચી નથી ત્યારે રચાય છે. સામાન્ય રીતે 100 ડિગ્રી કરતા વધારે તાપમાને અથવા સપાટી પરથી બાષ્પીભવન થાય છે. પ્રકૃતિમાં, આ વાદળો, ધુમ્મસ અને વરાળ છે. 19મી સદીમાં જ્યારે સ્ટીમ એન્જિનની શોધ થઈ ત્યારે કૃત્રિમ ગેસની રચનાએ તકનીકી પ્રગતિમાં મુખ્ય ભૂમિકા ભજવી હતી.
પ્રકૃતિમાં પદાર્થની માત્રા
75% - આ આંકડો વિશાળ લાગશે, પરંતુ આ ગ્રહ પરનું તમામ પાણી છે, તે પણ જે એકત્રીકરણની વિવિધ સ્થિતિમાં છે, જીવંત પ્રાણીઓ અને કાર્બનિક સંયોજનોમાં છે. જો આપણે ફક્ત પ્રવાહીને ધ્યાનમાં લઈએ, એટલે કે, સમુદ્ર અને મહાસાગરોમાં જોવા મળતા પાણી, તેમજ નક્કર પાણી - હિમનદીઓમાં, તો ટકાવારી 70.8% બને છે.
ટકાવારી વિતરણથોડું આના જેવું:
- સમુદ્ર અને મહાસાગરો - 74.8%
- તાજા સ્ત્રોતોમાંથી H2O, સમગ્ર ગ્રહ પર અસમાન રીતે વિતરિત, હિમનદીઓમાં 3.4% છે, અને તળાવો, સ્વેમ્પ્સ અને નદીઓમાં માત્ર 1.1% છે.
- ભૂગર્ભ સ્ત્રોતો કુલમાંથી આશરે 20.7% હિસ્સો ધરાવે છે.
ભારે પાણીની લાક્ષણિકતાઓ
કુદરતી પદાર્થ - હાઇડ્રોજન થાય છે ત્રણ આઇસોટોપ તરીકે, ઓક્સિજન પણ સમાન સંખ્યામાં સ્વરૂપોમાં અસ્તિત્વ ધરાવે છે. આ સામાન્ય પીવાના પાણી ઉપરાંત ડ્યુટેરિયમ અને ટ્રીટિયમને અલગ કરવાનું શક્ય બનાવે છે.
ડ્યુટેરિયમ સૌથી સ્થિર સ્વરૂપ ધરાવે છે, તે તમામ કુદરતી સ્ત્રોતોમાં જોવા મળે છે, પરંતુ ખૂબ ઓછી માત્રામાં. આ ફોર્મ્યુલા સાથેના પ્રવાહીમાં સરળ અને હળવાથી ઘણા તફાવત હોય છે. આમ, તેમાં સ્ફટિકોની રચના 3.82 ડિગ્રી તાપમાનથી પહેલાથી જ શરૂ થાય છે. પરંતુ ઉત્કલન બિંદુ સહેજ વધારે છે - 101.42 ડિગ્રી સેલ્સિયસ. તેની ઘનતા વધારે છે અને પદાર્થોને ઓગળવાની ક્ષમતામાં નોંધપાત્ર ઘટાડો થાય છે. તેને અલગ ફોર્મ્યુલા (D2O) દ્વારા પણ નિયુક્ત કરવામાં આવે છે.
જીવંત પ્રણાલીઓ પ્રતિક્રિયા આપે છેઆવા રાસાયણિક સંયોજન ખરાબ છે. ફક્ત અમુક પ્રકારના બેક્ટેરિયા જ તેમાં જીવનને અનુકૂલિત કરવામાં સક્ષમ હતા. માછલી આવા પ્રયોગથી બિલકુલ બચી ન હતી. માનવ શરીરમાં, ડ્યુટેરિયમ કેટલાક અઠવાડિયા સુધી રહી શકે છે, અને પછી નુકસાન પહોંચાડ્યા વિના દૂર થઈ જાય છે.
મહત્વપૂર્ણ!ડ્યુટેરિયમ પાણી પીવું પ્રતિબંધિત છે!
પાણીના અનન્ય ગુણધર્મો. - માત્ર.
નિષ્કર્ષ
પરમાણુ અને પરમાણુ ઉદ્યોગોમાં ભારે પાણીનો વ્યાપક ઉપયોગ થાય છે, અને સામાન્ય પાણીનો ઉપયોગ દરેક જગ્યાએ થાય છે.
હાઇડ્રોજન.
હાઇડ્રોજન એ પ્રકાશ, રંગહીન, ગંધહીન ગેસ છે. હાઇડ્રોજન પરમાણુમાં સહસંયોજક નોનપોલર બોન્ડ દ્વારા જોડાયેલા બે અણુઓ હોય છે.
| રસીદ: 1.ઉદ્યોગમાં: રૂપાંતર પદ્ધતિ.પ્રથમ, 1000 °C પર ગરમ કોકમાંથી પાણીની વરાળ પસાર કરીને પાણીનો ગેસ મેળવવામાં આવે છે: C + H 2 O -tà CO + H 2. પછી કાર્બન મોનોક્સાઇડ (II) 400–450 ° C: CO + H 2 O = CO 2 + H પર ગરમ થતા Fe 2 O 3 ઉત્પ્રેરક પર વધારાની પાણીની વરાળ સાથે પાણીના ગેસના મિશ્રણને પસાર કરીને કાર્બન મોનોક્સાઇડ (IV) માં ઓક્સિડાઇઝ કરવામાં આવે છે. 2. પાણીની વરાળ સાથે મિથેનનું ઓક્સિડેશન: CH 4 + 2H 2 O –(t, Ni)à4H 2 + CO 2 1200 °C પર મિથેનનું થર્મલ વિઘટન: CH 4 -tà C + 2H 2 ટેબલ મીઠાના જલીય દ્રાવણનું વિદ્યુત વિચ્છેદન અથવા સોડિયમ હાઇડ્રોક્સાઇડ: (NaOH) + 2H 2 O – વિદ્યુત પ્રવાહ 2H 2 + O 2 2NaCl + 2H 2 O – વિદ્યુત પ્રવાહ H 2 + Cl 2 + 2NaOH; 2. પ્રયોગશાળામાં: Zn + 2HCl à ZnCl 2 + H 2 2Al + 2NaOH + 6H 2 O = 2Na + 3H 2 ; Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2. | ગુણધર્મો: 1. ધાતુઓ સાથે: H 2 + 2Na -tà2NaH H 2 + Ca -tà CaH 2 2. બિન-ધાતુઓ સાથે: 2H 2 + O 2 à 2H 2 O H 2 + Cl 2 -hvà 2HCl 3H 2 + N 2 -t, p , cat.à 2NH 3 H 2 + S à H 2 S 3. ધાતુઓ (નિષ્ક્રિય) અને બિન-ધાતુઓના ઓક્સાઇડ સાથે: CuO + H 2 à Cu + H 2 O 2NO + 2H 2 = N 2 + 2H 2 O . |
ધાતુઓ અને બિન-ધાતુઓના હાઇડ્રોજન સંયોજનો.
1. આયોનિક હાઇડ્રાઇડ્સ: તૈયારી: H 2 + 2Na -tà2NaH
ગુણધર્મો: પાણી અને એસિડ સાથે વિઘટન:
NaH + H 2 O à NaOH + H 2
CaH 2 + 2HCl à CaCl 2 + 2H 2
2. સહસંયોજક હાઇડ્રોજન સંયોજનો:
પાણી સિવાયના તમામ વાયુઓ (હાઈડ્રોજન બોન્ડ).
અસ્થિર: ફોસ્ફાઈન અને સિલેન.
તેના મુખ્ય ગુણધર્મો છે: એમોનિયા.
એમ્ફોટેરિક ગુણધર્મો આના દ્વારા પ્રદર્શિત થાય છે: પાણી.
જલીય દ્રાવણમાં એસિડ રચાય છે: હાઇડ્રોજન સલ્ફાઇડ અને હાઇડ્રોજન હલાઇડ્સ.
પાણી.
પાણીના અણુઓ હાઇડ્રોજન બોન્ડ દ્વારા જોડાયેલા છે: nH 2 O = (H 2 O) n, તેથી પાણી પ્રવાહી છે, તેના વાયુયુક્ત એનાલોગ H 2 S, H 2 Se અને H 2 Te થી વિપરીત.
ગુણધર્મો:
1. ધાતુઓ સાથે:
a) આલ્કલાઇન અને આલ્કલાઇન પૃથ્વી (બેરિલિયમ અને મેગ્નેશિયમ સિવાય): 2Na + 2H 2 O = 2NaOH + H 2
b) H સુધીની પ્રવૃત્તિ શ્રેણીમાં બાકીની ધાતુઓને ઊંચા તાપમાને પાણીની વરાળ દ્વારા ઓક્સાઈડમાં ઓક્સિડાઇઝ કરી શકાય છે: Fe + 4H 2 O-tà Fe 3 O 4 + 4H 2
2. આલ્કલી અને આલ્કલાઇન પૃથ્વી ધાતુઓના ઓક્સાઇડ સાથે: H 2 O + CaO = Ca (OH) 2
3. દ્રાવ્ય એસિડના એસિડિક ઓક્સાઇડ સાથે: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
4. ક્ષારનું હાઇડ્રોલિસિસ, ધાતુઓના દ્વિસંગી સંયોજનો અને બિન-ધાતુઓ:
2CuSO 4 + 2H 2 O ⇄ (CuOH) 2 SO 4 + H 2 SO 4
Al 2 S 3 + 6H 2 O à 2Al(OH) 3 + 3H 2 S
Ca 3 P 2 + 6H 2 O à 3Ca(OH) 2 + 2РН 3
PCl 5 + 4H 2 O à H 3 PO 4 + 5HCl
હાઇડ્રોજનનો ઉપયોગ
હાઇડ્રોજનનો ઉપયોગ તેના ભૌતિક અને રાસાયણિક ગુણધર્મો પર આધારિત છે:
- હળવા ગેસ તરીકે, તેનો ઉપયોગ ફુગ્ગાઓ (હિલીયમ સાથે મિશ્રિત) ભરવા માટે થાય છે;
- ઓક્સિજન-હાઇડ્રોજન જ્યોતનો ઉપયોગ ધાતુઓને વેલ્ડિંગ કરતી વખતે ઉચ્ચ તાપમાન મેળવવા માટે થાય છે;
- ઘટાડનાર એજન્ટ તરીકે તેનો ઉપયોગ તેમના ઓક્સાઇડમાંથી ધાતુઓ (મોલિબડેનમ, ટંગસ્ટન વગેરે) મેળવવા માટે થાય છે;
- એમોનિયા અને કૃત્રિમ પ્રવાહી બળતણના ઉત્પાદન માટે, ચરબીના હાઇડ્રોજનેશન માટે.
IVA જૂથના તત્વો.

કાર્બન.
1. સરળ પદાર્થ. તેમાં ઘણા બધા એલોટ્રોપિક ફેરફારો છે: હીરા, ગ્રેફાઇટ, કાર્બાઇન, ફુલેરીન.
હીરા- એક સ્ફટિકીય પદાર્થ, પારદર્શક, પ્રકાશ કિરણોને મજબૂત રીતે પ્રતિબિંબિત કરે છે, ખૂબ જ સખત, વિદ્યુત પ્રવાહનું સંચાલન કરતું નથી અને ગરમીનું સંચાલન ખરાબ રીતે કરે છે. દરેક કાર્બન અણુ sp 3 વર્ણસંકરીકરણની સ્થિતિમાં છે.
ગ્રેફાઇટ- નબળા ધાતુની ચમક સાથેનો નરમ રાખોડી પદાર્થ, સ્પર્શ માટે ચીકણું, ઇલેક્ટ્રિક પ્રવાહનું સંચાલન કરે છે. કાર્બન પરમાણુ sp2 વર્ણસંકરીકરણની સ્થિતિમાં હોય છે અને હનીકોમ્બની જેમ કિનારીઓ દ્વારા જોડાયેલા ષટ્કોણ ધરાવતા સપાટ સ્તરોમાં બંધાયેલા હોય છે.
ગ્રેફાઇટ એ ઓરડાના તાપમાને કાર્બનનું સૌથી સ્થિર એલોટ્રોપિક ફેરફાર છે.
કાર્બિન- ફાઇન-સ્ફટિકીય ગ્રે પાવડર, સેમિકન્ડક્ટર. તેના સ્ફટિકોમાં વૈકલ્પિક ટ્રિપલ અને સિંગલ બોન્ડ્સ અથવા ડબલ બોન્ડ દ્વારા જોડાયેલા કાર્બન અણુઓની રેખીય સાંકળોનો સમાવેશ થાય છે, કાર્બન એસપી-સંકરીકરણની સ્થિતિમાં છે: -С≡С-С≡С-С≡С-С≡С-
કાર્બાઇન કઠિનતામાં ગ્રેફાઇટ કરતાં શ્રેષ્ઠ છે, પરંતુ હીરા કરતાં નોંધપાત્ર રીતે હલકી ગુણવત્તાવાળા છે.
ફુલેરીન -કાર્બનનું કૃત્રિમ રીતે મેળવેલ ફેરફાર, જેમાં C 60, C 70, .... પરમાણુઓનો સમાવેશ થાય છે. સી 1020. આ પરમાણુઓ સામાન્ય ધાર સાથે પંચકોણ અને ષટ્કોણમાં ગોઠવાયેલા કાર્બન અણુઓથી બનેલા છે. આ ધાતુની ચમકવાળા કાળા પદાર્થો છે જે સેમિકન્ડક્ટર ગુણધર્મો ધરાવે છે. 2·10 5 atm અને ઓરડાના તાપમાનના ક્રમના દબાણ પર, ફુલેરીન હીરામાં પરિવર્તિત થાય છે.
કાર્બન ગુણધર્મો:
| ફ્લોરિન સાથે ક્રિયાપ્રતિક્રિયા: કાર્બનમાં હેલોજનની ઓછી પ્રતિક્રિયા હોય છે, તે માત્ર ફ્લોરિન સાથે પ્રતિક્રિયા આપે છે. | C + 2F 2 = CF 4. |
| ઓક્સિજન સાથે ક્રિયાપ્રતિક્રિયા: | 2C + O 2 (અપૂરતી) = 2CO (કાર્બન મોનોક્સાઇડ), C + O 2 (વધારે) = CO 2 (કાર્બન ડાયોક્સાઇડ). |
| અન્ય બિન-ધાતુઓ સાથે ક્રિયાપ્રતિક્રિયા: નાઇટ્રોજન અને ફોસ્ફરસ સાથે ક્રિયાપ્રતિક્રિયા કરતું નથી. | C + 2S = CS 2 C + 2H 2 –t, Nià CH 4 Ca + 2C = CaC 2 3C + 4Al = Al 4 C 3 |
| પાણી સાથે ક્રિયાપ્રતિક્રિયા: જ્યારે પાણીની વરાળ ગરમ કોલસામાંથી પસાર થાય છે, ત્યારે કાર્બન મોનોક્સાઇડ (II) અને હાઇડ્રોજન રચાય છે: | C + H 2 O = CO + H 2. |
| ઘટાડાના ગુણધર્મો: કાર્બન તેમના ઓક્સાઇડમાંથી ઘણી ધાતુઓને ઘટાડવામાં સક્ષમ છે: | 2ZnO + C –tà 2Zn + CO 4C + Fe 3 O 4 -tà 3Fe + 4CO |
| કેન્દ્રિત સલ્ફ્યુરિક અને નાઈટ્રિક એસિડ, જ્યારે ગરમ થાય છે, ત્યારે કાર્બનને કાર્બન મોનોક્સાઇડ (IV) માં ઓક્સિડાઇઝ કરે છે: | C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O; C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O. |
કાર્બાઈડ્સ - આ ધાતુઓ સાથે કાર્બનના સંયોજનો છે.
કાર્બન ઓક્સાઇડ.
| CO | CO2 | |
| લાક્ષણિકતા | કાર્બન મોનોક્સાઇડ - b\c, b\z, ઝેરી | કાર્બન ડાયોક્સાઇડ - b/c, b/z |
| કાર્બન મોનોક્સાઇડ પરમાણુ (II) એક રેખીય માળખું ધરાવે છે. કાર્બન અને ઓક્સિજન પરમાણુ વચ્ચે ટ્રિપલ બોન્ડ રચાય છે. | CO 2 પરમાણુ રેખીય છે, કાર્બન હાઇબ્રિડાઇઝેશનનો પ્રકાર sp 2 છે | |
| ઓક્સાઇડ પ્રકાર | બિન-મીઠું બનાવતું | તેજાબ |
| CO + NaOH = HCOONa (સોડિયમ ફોર્મેટ) 2CO + O 2 = 2CO 2 CO + H 2 = C + H 2 O CO + Cl 2 = COCl 2 (ફોસજીન) CO + CuO = Cu + CO 2 | C + CO 2 = 2CO. 2Mg + CO 2 = 2MgO + C. લાક્ષણિક એસિડિક ઓક્સાઇડ. Na 2 O + CO 2 = Na 2 CO 3, 2NaOH + CO 2 = Na 2 CO 3 + H 2 O, NaOH + CO 2 = NaHCO 3. કાર્બન ડાયોક્સાઇડ શોધવા માટેની ગુણાત્મક પ્રતિક્રિયા એ ચૂનાના પાણીની ગંદકી છે: Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O. | |
| રસીદ | 1) ગરમ કોલસામાંથી હવા પસાર કરતી વખતે ગેસ જનરેટરમાં રચાય છે: C + O 2 = CO 2, CO 2 + C = 2CO. 2) કેન્દ્રિત સલ્ફ્યુરિક એસિડની હાજરીમાં ફોર્મિક અથવા ઓક્સાલિક એસિડના થર્મલ વિઘટન દ્વારા મેળવવામાં આવે છે: HCOOH = H 2 O + CO, H 2 C 2 O 4 = CO + CO 2 + H 2 O | કાર્બન ડાયોક્સાઇડ ચૂનાના પથ્થરને બાળીને મેળવવામાં આવે છે: CaCO 3 = CaO + CO 2, અથવા કાર્બોનેટ અને બાયકાર્બોનેટ પર મજબૂત એસિડની ક્રિયા દ્વારા: CaCO 3 +2HCl = CaCl 2 +H 2 O + CO 2, NaHCO 3 + HCl = NaCl + H 2 O + CO 2. |

કાર્બોનિક એસિડ H 2 CO 3
જ્યારે કાર્બન ડાયોક્સાઇડ પાણીમાં ઓગળી જાય છે, ત્યારે તે ખૂબ જ નબળો બને છે કાર્બનિક એસિડ H 2 CO 3.
પાણીમાં કાર્બન ડાયોક્સાઇડ મુખ્યત્વે સ્વરૂપમાં હોય છે હાઇડ્રેટેડ CO 2 અણુઓ અને માત્ર કાર્બોનિક એસિડના રૂપમાં થોડી હદ સુધી. આ કિસ્સામાં, ઉકેલમાં સંતુલન સ્થાપિત થાય છે:
CO 2 (g) + H 2 O ⇄ CO 2 H 2 O (ઉકેલ) ⇄ H 2 CO 3 ⇄ H + + HCO 3 -
કાર્બોનિક એસિડ એક નબળું, અસ્થિર એસિડ છે જે મુક્ત સ્થિતિમાં જલીય દ્રાવણથી અલગ કરી શકાતું નથી.

કાર્બોનેટ.
1) મેટલ કાર્બોનેટ ( આલ્કલાઇન સિવાયજ્યારે ગરમ થાય ત્યારે વિઘટન થાય છે:
CuCO3 – tà CuO + CO 2
2) જ્યારે કાર્બન ડાયોક્સાઇડ પસાર થાય છે, ત્યારે કાર્બોનેટમાંથી હાઇડ્રોકાર્બોનેટ બને છે:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2.
3) હાઇડ્રોકાર્બોનેટ્સ કાર્બોનેટમાં વિઘટિત થાય છે: 2NaHCO 3 – tà Na 2 CO 3 + H 2 O + CO 2 .
4) કાર્બોનેટ અને બાયકાર્બોનેટ વિનિમય પ્રતિક્રિયાઓમાં પ્રવેશ કરે છે:
a) મજબૂત એસિડ સાથે (કાર્બોનેટની ગુણાત્મક પ્રતિક્રિયા):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
b) દ્રાવ્ય ક્ષાર અને પાયા સાથે, જો અવક્ષેપ રચાય છે:
Na 2 CO 3 + Ba(OH) 2 = BaCO 3 ↓+ 2NaOH
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓+ 2NaCl
5) હાઇડ્રોકાર્બોનેટ આલ્કલી સાથે પ્રતિક્રિયા આપે છે, મધ્યમ ક્ષાર બનાવે છે:
KNSO 3 + KOH = K 2 CO 3 + H 2 O
સિલિકોન.
| સામયિક કોષ્ટકના જૂથ IV માં સ્થિત છે. બાહ્ય સ્તરમાં 4 ઇલેક્ટ્રોન છે, જેનું ઇલેક્ટ્રોન રૂપરેખાંકન 3s 2 3p 2 છે. ઓક્સિડેશન સ્થિતિ -4, +2, +4 બતાવે છે. | ઓક્સિજન પછી પૃથ્વી પરનું બીજું સૌથી વધુ વિપુલ તત્વ. માત્ર સંયોજનોના સ્વરૂપમાં જોવા મળે છે. સૌથી મહત્વપૂર્ણ સિલિકોન સંયોજન- SiO 2 ઓક્સાઇડ મોટા પ્રમાણમાં કુદરતી પદાર્થો બનાવે છે - રોક ક્રિસ્ટલ, ક્વાર્ટઝ, સિલિકા. છોડ અને પ્રાણીઓના જીવન માટે SiO 2 જરૂરી છે. તે છોડની દાંડી અને પ્રાણીઓના રક્ષણાત્મક આવરણને શક્તિ આપે છે. તેના માટે આભાર, રીડ્સ, રીડ્સ અને ઘોડાની પૂંછડીઓ બેયોનેટની જેમ મજબૂત છે, તીક્ષ્ણ સેજ પાંદડા છરીની જેમ કાપવામાં આવે છે, સોયની જેમ કાપેલા ખેતરમાં સ્ટબલ, અને અનાજની દાંડી એટલી મજબૂત છે કે તેઓ ખેતરોમાંના ખેતરોને મંજૂરી આપતા નથી. વરસાદ અને પવનથી નીચે સૂઈ જાઓ. માછલીના ભીંગડા, જંતુના શેલ, બટરફ્લાયની પાંખો, પક્ષીઓના પીછાઓ અને પ્રાણીઓની રૂંવાટી ટકાઉ હોય છે કારણ કે તેમાં સિલિકા હોય છે. |
ભૌતિક ગુણધર્મો.પદાર્થ ધાતુની ચમક સાથે ઘેરો રાખોડી રંગનો છે, તદ્દન નાજુક. ગલનબિંદુ 1415 °C, ઘનતા 2.33 g/cm3. સેમિકન્ડક્ટર. ધાતુઓથી વિપરીત, તેની વિદ્યુત વાહકતા વધતા તાપમાન સાથે વધે છે. ઉપગ્રહો, અવકાશયાન અને સ્ટેશનો પર સૌર પેનલ સ્થાપિત કરવામાં આવે છે, જે સૌર ઊર્જાને વિદ્યુત ઊર્જામાં રૂપાંતરિત કરે છે. તેઓ સેમિકન્ડક્ટર ક્રિસ્ટલ્સનો ઉપયોગ કરે છે, મુખ્યત્વે સિલિકોન.
સિલિકોન સૌર કોષો 10% સુધી શોષિત સૌર ઊર્જાને વીજળીમાં રૂપાંતરિત કરી શકે છે.
રાસાયણિક ગુણધર્મો:
સિલિકોન એક લાક્ષણિક બિન-ધાતુ છે; તે ઓક્સિડાઇઝિંગ એજન્ટ અને ઘટાડનાર એજન્ટ હોઈ શકે છે.
| હેલોજન સાથેની ક્રિયાપ્રતિક્રિયા: ફક્ત ફ્લોરિન સાથે સીધી ક્રિયાપ્રતિક્રિયા કરે છે. જ્યારે ગરમ થાય ત્યારે ક્લોરિન સાથે પ્રતિક્રિયા આપે છે. | Si + 2F 2 = SiF 4 Si + 2Cl 2 -tà SiCl 4 |
| ઓક્સિજન સાથે ક્રિયાપ્રતિક્રિયા | Si + O 2 -tàSiO 2 |
| અન્ય બિન-ધાતુઓ સાથે ક્રિયાપ્રતિક્રિયા: હાઇડ્રોજન સાથે ક્રિયાપ્રતિક્રિયા કરતું નથી. | Si + C -tàSiC 3Si + 2N 2 = Si 3 N 4 |
| હાઇડ્રોજન હલાઇડ્સ સાથે ક્રિયાપ્રતિક્રિયા. તે સામાન્ય સ્થિતિમાં હાઇડ્રોજન ફ્લોરાઇડ સાથે, હાઇડ્રોજન ક્લોરાઇડ સાથે - 300 °C પર, હાઇડ્રોજન બ્રોમાઇડ સાથે - 500 °C પર પ્રતિક્રિયા આપે છે. | Si + 4HF = SiF 4 + 2H 2 |
| ધાતુઓ સાથે ક્રિયાપ્રતિક્રિયા: સિલિસાઇડ્સ બનાવે છે. | 2Ca + Si = Ca 2 Si કેલ્શિયમ સિલિસાઇડ Si + 2Mg = Mg 2 Si સિલિસાઇડ્સ પાણી અથવા એસિડ દ્વારા સરળતાથી વિઘટિત થાય છે, સિલિકોન - સિલેનનું વાયુયુક્ત હાઇડ્રોજન સંયોજન મુક્ત કરે છે: Mg 2 Si + 2H 2 SO 4 = 2MgSO 4 + SiH 4 વિપરીત હાઇડ્રોકાર્બન, હવામાં સિલેન સ્વયંભૂ સળગે છે અને સિલિકોન ડાયોક્સાઇડ અને પાણી બનાવે છે: SiH 4 + 20 2 = SiO 2 + 2H 2 O મિથેન CH 4 ની સરખામણીમાં સિલેનની વધેલી પ્રતિક્રિયા એ હકીકત દ્વારા સમજાવવામાં આવે છે કે સિલિકોનનું અણુ કદ મોટું છે. કાર્બન કરતાં, તેથી, -H રાસાયણિક બોન્ડ C-H બોન્ડ કરતાં નબળા છે. |
| એસિડ સાથે ક્રિયાપ્રતિક્રિયા. એસિડ માટે પ્રતિરોધક, માત્ર હાઇડ્રોફ્લોરિક અને નાઈટ્રિક એસિડના મિશ્રણ સાથે ક્રિયાપ્રતિક્રિયા કરે છે. | 3Si + 4HNO3 + 18HF = 3H2 + 4NO + 8H2O |
| આલ્કલીસમાં ઓગળીને સિલિકેટ અને હાઇડ્રોજન બનાવે છે: | Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2 |
સિલિકોનની તૈયારી.
સિલિસાઇડ્સ -ધાતુઓ સાથે સિલિકોનના સંયોજનો જેમાં સિલિકોનની ઓક્સિડેશન સ્થિતિ -4 હોય છે.
આલ્કલી અને આલ્કલાઇન પૃથ્વી ધાતુઓના સિલિસાઇડ્સ દ્વારા વર્ગીકૃત કરવામાં આવે છે આયનીય પ્રકારબોન્ડ્સ, તેઓ રાસાયણિક રીતે સક્રિય છે. તેઓ સિલેન છોડવા સાથે પાણી અથવા પાતળું એસિડ દ્વારા સરળતાથી વિઘટિત થાય છે: Ca 2 Si + 2H 2 SO 4 = 2CaSO 4 + SiH 4.
બિન-ધાતુના સિલિસાઇડ્સમાં સહસંયોજક બંધન હોય છે. આવા સિલિસાઇડ્સમાં, સૌથી મહત્વપૂર્ણ સિલિકોન કાર્બાઇડ છે - કાર્બોરન્ડમ SiC, જે હીરાની રચના ધરાવે છે, તે ઉચ્ચ કઠિનતા અને ગલનબિંદુ, તેમજ ઉચ્ચ રાસાયણિક પ્રતિકાર દ્વારા વર્ગીકૃત થયેલ છે;
ઇલેક્ટ્રીક ભઠ્ઠીઓમાં સાદા પદાર્થોને ફ્યુઝ કરીને અથવા કોક સાથે ઓક્સાઇડના મિશ્રણને ઘટાડીને સિલિસાઇડ્સ મેળવવામાં આવે છે: 2Mg + Si = Mg 2 Si,
2MgO + SiO 2 + 4C = Mg 2 Si + 4CO.
સિલેન SiH 4. (મોનોસિલેન).
સિલિકોન(IV) ઓક્સાઇડ- એસિડ ઓક્સાઇડ.
પ્રકૃતિમાં - નદી રેતી, ક્વાર્ટઝ.
પાણી સાથે પ્રતિક્રિયા કરતું નથી - કારણ કે સિલિકિક એસિડ અદ્રાવ્ય છે.
2) જ્યારે ફ્યુઝ થાય છે, ત્યારે તે આલ્કલીસ સાથે પ્રતિક્રિયા આપે છે: SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
3) મૂળભૂત ઓક્સાઇડ્સ સાથે પ્રતિક્રિયા આપે છે: SiO 2 + MgO -tàMgSiO 3 અને આલ્કલી મેટલ કાર્બોનેટ: SiO 2 + K 2 CO 3 -tà K 2 SiO 3 + CO 2 ફ્યુઝન દરમિયાન.
4) એસિડમાંથી ઓગળી જાય છે માત્ર ફ્લોરોસન્ટમાં: SiO 2 + 6HF = H 2 + 2H 2 O
5) 1000 ° સે ઉપરના તાપમાને, તે સક્રિય ધાતુઓ સાથે પ્રતિક્રિયા આપે છે, જેના પરિણામે સિલિકોનનું નિર્માણ થાય છે: SiO 2 + 2Mg = Si + 2MgO
અથવા રિડ્યુસિંગ એજન્ટના વધારા સાથે - સિલિસાઇડ્સ: SiO 2 + 4Mg = Mg 2 Si + 2MgO.
6) બિન-ધાતુઓ સાથે ક્રિયાપ્રતિક્રિયા.
હાઇડ્રોજન સાથે પ્રતિક્રિયા આપે છે: SiO 2 + 2H 2 = Si + 2H 2 O,
કાર્બન સાથે ક્રિયાપ્રતિક્રિયા કરે છે: SiO 2 + 3C = SiC + 2CO.
સિલિકિક એસિડ.
તેમાં પોલિમર માળખું અને રચના xSiO 2 yH 2 O છે. ઓર્થોસિલિકોન H 4 SiO 4 અને મેટાસિલિકોન H 2 SiO 3 એસિડનું અસ્તિત્વ જલીય દ્રાવણમાં સાબિત થયું છે.

રસીદ:માત્ર પરોક્ષ રીતે, ક્ષારમાંથી: Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
Na 2 SiO 3 + 2H 2 O + 2CO 2 = 2NaHCO 3 + H 2 SiO 3 ↓,
ગુણધર્મો: 1) કેન્દ્રિત આલ્કલીમાં ઓગળે છે: H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
2) જ્યારે ગરમ થાય ત્યારે વિઘટન થાય છે: H 2 SiO 3 -tàSiO 2 + H 2 O
સિલિકેટ્સ.
મોટાભાગના પાણીમાં અદ્રાવ્ય હોય છે, સોડિયમ અને પોટેશિયમ સિલિકેટ્સ સિવાય, તેમને "પ્રવાહી કાચ" કહેવામાં આવે છે. તેમના જલીય દ્રાવણો જાણીતા સિલિકેટ ગુંદર છે.
રસીદ: 1) આલ્કલીમાં સિલિકોન, સિલિકિક એસિડ અથવા ઓક્સાઇડ ઓગળવું:
H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2
SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
2) ઓક્સાઇડનું ફ્યુઝન: CaO + SiO 2 -tà CaSiO 3
3) કાર્બોનેટ સાથે સિલિકોન ડાયોક્સાઇડના મિશ્રણ દ્વારા: SiO 2 + CaC0 3 = CaSiO 3 + C0 2
4) ક્ષારની ક્રિયાપ્રતિક્રિયા: K 2 SiO 3 + CaCl 2 = CaSiO 3 + 2KCl
સિલિકેટ્સનાં દ્રાવણમાંથી, તેમના પર મજબૂત એસિડની ક્રિયા દ્વારા - હાઇડ્રોક્લોરિક, સલ્ફ્યુરિક, એસિટિક અને કાર્બનિક, સિલિકિક એસિડ H 2 SiO 3 મેળવવામાં આવે છે:
K 2 SiO 3 + 2HCl = 2KSl + H 2 SiO 3
તેથી, H 2 SiO 3 એ ખૂબ જ નબળું એસિડ છે. તે પાણીમાં અદ્રાવ્ય છે અને જિલેટીનસ અવક્ષેપના રૂપમાં પ્રતિક્રિયા મિશ્રણમાંથી બહાર પડે છે, કેટલીકવાર તે દ્રાવણના સમગ્ર જથ્થાને સઘન રીતે ભરે છે, તેને જેલી અથવા જેલી જેવા અર્ધ-ઘન સમૂહમાં ફેરવે છે. જ્યારે આ સમૂહ સુકાઈ જાય છે, ત્યારે એક અત્યંત છિદ્રાળુ પદાર્થ બને છે - સિલિકા જેલ, જેનો વ્યાપકપણે શોષક તરીકે ઉપયોગ થાય છે - અન્ય પદાર્થોનું શોષક.
સૌ પ્રથમ, યાદ રાખો કે ધાતુઓને સામાન્ય રીતે ત્રણ જૂથોમાં વહેંચવામાં આવે છે:
1) પ્રતિક્રિયાશીલ ધાતુઓ: આ ધાતુઓમાં તમામ આલ્કલી ધાતુઓ, આલ્કલાઇન પૃથ્વી ધાતુઓ, તેમજ મેગ્નેશિયમ અને એલ્યુમિનિયમનો સમાવેશ થાય છે.
2) મધ્યવર્તી પ્રવૃત્તિની ધાતુઓ: આ પ્રવૃત્તિ શ્રેણીમાં એલ્યુમિનિયમ અને હાઇડ્રોજન વચ્ચે સ્થિત ધાતુઓનો સમાવેશ કરે છે.
3) ઓછી સક્રિય ધાતુઓ: હાઇડ્રોજનની જમણી બાજુએ પ્રવૃત્તિ શ્રેણીમાં સ્થિત ધાતુઓ.
સૌ પ્રથમ, તમારે યાદ રાખવાની જરૂર છે કે ઓછી સક્રિય ધાતુઓ (એટલે કે જે હાઇડ્રોજન પછી સ્થિત છે) કોઈપણ પરિસ્થિતિમાં પાણી સાથે પ્રતિક્રિયા કરતી નથી.
આલ્કલી અને આલ્કલાઇન ધરતીની ધાતુઓ કોઈપણ પરિસ્થિતિમાં (સામાન્ય તાપમાને અને ઠંડીમાં પણ) પાણી સાથે પ્રતિક્રિયા આપે છે, અને પ્રતિક્રિયા હાઇડ્રોજનના પ્રકાશન અને મેટલ હાઇડ્રોક્સાઇડની રચના સાથે થાય છે. દાખ્લા તરીકે:
2Na + 2H 2 O = 2NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
મેગ્નેશિયમ, એ હકીકતને કારણે કે તે રક્ષણાત્મક ઓક્સાઇડ ફિલ્મથી ઢંકાયેલું છે, જ્યારે ઉકાળવામાં આવે ત્યારે જ પાણી સાથે પ્રતિક્રિયા આપે છે. જ્યારે પાણીમાં ગરમ થાય છે, ત્યારે MgO ધરાવતી ઓક્સાઇડ ફિલ્મ નાશ પામે છે અને નીચેનું મેગ્નેશિયમ પાણી સાથે પ્રતિક્રિયા આપવાનું શરૂ કરે છે. આ કિસ્સામાં, પ્રતિક્રિયા હાઇડ્રોજનના પ્રકાશન અને મેટલ હાઇડ્રોક્સાઇડની રચના સાથે પણ છે, જે, જો કે, મેગ્નેશિયમના કિસ્સામાં અદ્રાવ્ય છે:
Mg + 2H 2 O = Mg(OH) 2 ↓ + H 2
એલ્યુમિનિયમ, મેગ્નેશિયમની જેમ, એક રક્ષણાત્મક ઓક્સાઇડ ફિલ્મ સાથે આવરી લેવામાં આવે છે, પરંતુ આ કિસ્સામાં તેને ઉકાળીને નાશ કરી શકાતો નથી. તેને દૂર કરવા માટે, કાં તો યાંત્રિક સફાઈ (અમુક પ્રકારના ઘર્ષક સાથે) અથવા ક્ષાર સાથે તેના રાસાયણિક વિનાશ, પારાના ક્ષાર અથવા એમોનિયમ ક્ષારના ઉકેલો જરૂરી છે:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
મધ્યમ પ્રવૃત્તિની ધાતુઓ પાણી સાથે ત્યારે જ પ્રતિક્રિયા આપે છે જ્યારે તે અતિ ગરમ પાણીની વરાળની સ્થિતિમાં હોય. ધાતુ પોતે જ લાલ-ગરમ તાપમાન (લગભગ 600-800 o C) સુધી ગરમ થવી જોઈએ. સક્રિય ધાતુઓથી વિપરીત, મધ્યવર્તી પ્રવૃત્તિ ધરાવતી ધાતુઓ પાણી સાથે પ્રતિક્રિયા કરીને હાઇડ્રોક્સાઇડને બદલે મેટલ ઓક્સાઇડ બનાવે છે. આ કિસ્સામાં ઘટાડો ઉત્પાદન હાઇડ્રોજન છે.
વ્યાખ્યા
પાણી- હાઇડ્રોજન ઓક્સાઇડ એ અકાર્બનિક પ્રકૃતિનું દ્વિસંગી સંયોજન છે.
ફોર્મ્યુલા - H 2 O. મોલર માસ - 18 ગ્રામ/મોલ. તે એકત્રીકરણની ત્રણ અવસ્થામાં અસ્તિત્વ ધરાવે છે - પ્રવાહી (પાણી), ઘન (બરફ) અને વાયુયુક્ત (પાણીની વરાળ).
પાણીના રાસાયણિક ગુણધર્મો
પાણી એ સૌથી સામાન્ય દ્રાવક છે. પાણીના દ્રાવણમાં સંતુલન હોય છે, તેથી જ પાણીને એમ્ફોલાઇટ કહેવામાં આવે છે:
H 2 O ↔ H + + OH — ↔ H 3 O + + OH — .
ઇલેક્ટ્રિક પ્રવાહના પ્રભાવ હેઠળ, પાણી હાઇડ્રોજન અને ઓક્સિજનમાં વિઘટિત થાય છે:
H 2 O = H 2 + O 2.
ઓરડાના તાપમાને, પાણી સક્રિય ધાતુઓને ઓગાળીને આલ્કલી બનાવે છે, અને હાઇડ્રોજન પણ મુક્ત થાય છે:
2H 2 O + 2Na = 2NaOH + H 2.
પાણી ફ્લોરિન અને ઇન્ટરહેલાઇડ સંયોજનો સાથે ક્રિયાપ્રતિક્રિયા કરવામાં સક્ષમ છે, અને બીજા કિસ્સામાં પ્રતિક્રિયા નીચા તાપમાને થાય છે:
2H 2 O + 2F 2 = 4HF + O 2.
3H 2 O +IF 5 = 5HF + HIO 3.
નબળા આધાર અને નબળા એસિડ દ્વારા બનેલા ક્ષાર જ્યારે પાણીમાં ઓગળવામાં આવે ત્યારે હાઇડ્રોલિસિસમાંથી પસાર થાય છે:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S.
જ્યારે ગરમ થાય ત્યારે પાણી કેટલાક પદાર્થો, ધાતુઓ અને બિન-ધાતુઓને ઓગાળી શકે છે:
4H 2 O + 3Fe = Fe 3 O 4 + 4H 2;
H 2 O + C ↔ CO + H 2 .
પાણી, સલ્ફ્યુરિક એસિડની હાજરીમાં, અસંતૃપ્ત હાઇડ્રોકાર્બન્સ સાથે ક્રિયાપ્રતિક્રિયા પ્રતિક્રિયાઓ (હાઇડ્રેશન) માં પ્રવેશ કરે છે - સંતૃપ્ત મોનોહાઇડ્રિક આલ્કોહોલની રચના સાથે એલ્કેન્સ:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH.
પાણીના ભૌતિક ગુણધર્મો
પાણી એક સ્પષ્ટ પ્રવાહી (n.s.) છે. દ્વિધ્રુવ ક્ષણ 1.84 D છે (ઓક્સિજન અને હાઇડ્રોજનની ઇલેક્ટ્રોનેગેટિવિટીમાં મજબૂત તફાવતને કારણે). પ્રવાહી અને ઘન એકંદર અવસ્થામાં તમામ પદાર્થોમાં પાણીમાં સૌથી વધુ વિશિષ્ટ ઉષ્મા ક્ષમતા હોય છે. પાણીના મિશ્રણની વિશિષ્ટ ગરમી 333.25 kJ/kg (0 C), બાષ્પીભવન 2250 kJ/kg છે. પાણી ધ્રુવીય પદાર્થોને ઓગાળી શકે છે. પાણીમાં ઉચ્ચ સપાટી તણાવ અને નકારાત્મક સપાટીની વિદ્યુત સંભાવના છે.
પાણી મેળવવું
પાણી તટસ્થતાની પ્રતિક્રિયા દ્વારા મેળવવામાં આવે છે, એટલે કે. એસિડ અને આલ્કલીસ વચ્ચેની પ્રતિક્રિયાઓ:
H 2 SO 4 + 2KOH = K 2 SO 4 + H 2 O;
HNO 3 + NH 4 OH = NH 4 NO 3 + H 2 O;
2CH 3 COOH + Ba(OH) 2 = (CH 3 COO) 2 Ba + H 2 O.
પાણી મેળવવાની એક રીત એ છે કે તેમના ઓક્સાઇડમાંથી હાઇડ્રોજન ધરાવતી ધાતુઓનો ઘટાડો:
CuO + H 2 = Cu + H 2 O.
સમસ્યા હલ કરવાના ઉદાહરણો
ઉદાહરણ 1
| કસરત | 20% એસિટિક એસિડના દ્રાવણમાંથી 5% ઉકેલ તૈયાર કરવા માટે તમારે કેટલું પાણી લેવાની જરૂર છે? |
| ઉકેલ | પદાર્થના સામૂહિક અપૂર્ણાંકની વ્યાખ્યા અનુસાર, 20% એસિટિક એસિડનું દ્રાવણ 80 મિલી દ્રાવક (પાણી) 20 ગ્રામ એસિડ છે અને 5% એસિટિક એસિડનું દ્રાવણ 95 મિલી દ્રાવક (પાણી) 5 ગ્રામ એસિડ છે. . ચાલો પ્રમાણ બનાવીએ: x = 20 × 95/5 = 380. તે. નવા સોલ્યુશન (5%)માં 380 મિલી દ્રાવક હોય છે. તે જાણીતું છે કે પ્રારંભિક સોલ્યુશનમાં 80 મિલી દ્રાવક હોય છે. તેથી, 20% સોલ્યુશનમાંથી એસિટિક એસિડનું 5% સોલ્યુશન મેળવવા માટે, તમારે ઉમેરવાની જરૂર છે: 380-80 = 300 મિલી પાણી. |
| જવાબ આપો | તમારે 300 મિલી પાણીની જરૂર છે. |
ઉદાહરણ 2
| કસરત | જ્યારે 4.8 ગ્રામ વજનવાળા કાર્બનિક પદાર્થને બાળવામાં આવ્યો ત્યારે 3.36 લિટર કાર્બન ડાયોક્સાઈડ (NC) અને 5.4 ગ્રામ પાણીની રચના થઈ. કાર્બનિક પદાર્થોની હાઇડ્રોજન ઘનતા 16 છે. કાર્બનિક પદાર્થોનું સૂત્ર નક્કી કરો. |
| ઉકેલ | D.I દ્વારા રાસાયણિક તત્વોના કોષ્ટકનો ઉપયોગ કરીને ગણતરી કરાયેલ કાર્બન ડાયોક્સાઇડ અને પાણીના મોલર માસ. મેન્ડેલીવ - અનુક્રમે 44 અને 18 ગ્રામ/મોલ. ચાલો પ્રતિક્રિયા ઉત્પાદનોમાં પદાર્થની માત્રાની ગણતરી કરીએ: n(CO 2) = V(CO 2) / V m; n(H 2 O) = m(H 2 O) / M(H 2 O); n(CO 2) = 3.36 / 22.4 = 0.15 mol; n(H 2 O) = 5.4 / 18 = 0.3 મોલ. CO 2 પરમાણુમાં એક કાર્બન અણુ હોય છે અને H 2 O પરમાણુમાં 2 હાઇડ્રોજન અણુ હોય છે તે ધ્યાનમાં લેતા, આ અણુઓના પદાર્થ અને દળની માત્રા સમાન હશે: n(C) = 0.15 mol; n(H) = 2×0.3 mol; m(C) = n(C)× M(C) = 0.15 × 12 = 1.8 g; m(N) = n(N)× M(N) = 0.3 × 1 = 0.3 g. ચાલો નક્કી કરીએ કે કાર્બનિક પદાર્થમાં ઓક્સિજન છે કે કેમ: m(O) = m(C x H y O z) – m(C) – m(H) = 4.8 – 0.6 – 1.8 = 2.4 g. ઓક્સિજન અણુઓના પદાર્થની માત્રા: n(O) = 2.4 / 16 = 0.15 મોલ. પછી, n(C): n(H): n(O) = 0.15: 0.6: 0.15. નાનામાં નાના મૂલ્ય દ્વારા ભાગાકાર કરીએ તો આપણને n(C):n(H): n(O) = 1: 4: 1 મળે છે. તેથી, કાર્બનિક પદાર્થનું સૂત્ર CH 4 O છે. ગણતરી કરેલ કાર્બનિક પદાર્થનું દાળ દળ રાસાયણિક તત્વોના કોષ્ટકનો ઉપયોગ કરીને D.I. મેન્ડેલીવ - 32 ગ્રામ/મોલ. કાર્બનિક પદાર્થના દાઢ સમૂહ, તેની હાઇડ્રોજન ઘનતાનો ઉપયોગ કરીને ગણતરી કરવામાં આવે છે: M(C x H y O z) = M(H 2) × D(H 2) = 2 × 16 = 32 g/mol. જો કમ્બશન પ્રોડક્ટ્સ અને હાઇડ્રોજન ડેન્સિટીનો ઉપયોગ કરીને મેળવેલા કાર્બનિક પદાર્થના સૂત્રો અલગ હોય, તો દાળના સમૂહનો ગુણોત્તર 1 કરતા વધારે હશે. ચાલો આ તપાસીએ: M(C x H y O z) / M(CH 4 O) = 1. તેથી, કાર્બનિક પદાર્થનું સૂત્ર CH 4 O છે. |
| જવાબ આપો | કાર્બનિક પદાર્થોનું સૂત્ર CH 4 O છે. |