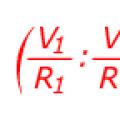Saf haliyle sodyum, 1807'de sodyumu kısa bir süre önce keşfeden İngiliz kimyager Humphry Davy tarafından elde edildi. Davy, sodyum elde ettiği sodyum bileşiklerinden biri olan hidroksitin elektroliz işlemini eriterek gerçekleştirdi. İnsanlık eski çağlardan beri sodyum bileşiklerini kullanıyor, doğal kökenli soda Eski Mısır'da (kalorizatör) kullanılıyordu. Öğeyi adlandırdı sodyum (sodyum) , bazen bu adın kendisi şimdi bile bulunabilir. Genel adı sodyumdur (Latince'den sodyum- soda) İsveçli Jens Berzelius tarafından önerildi.
Sodyum, kimyasal elementler D.I.'nin periyodik tablosunun üçüncü periyodunun I. Grubunun bir elementidir. Mendeleev'in atom numarası 11 ve atom kütlesi 22,99'dur. Kabul edilen atama Hayır(Latince'den sodyum).
Doğada olmak
Sodyum bileşikleri, yerkabuğunda ve deniz suyunda, radyasyonun etkisiyle kaya tuzunu maviye boyayan bir yabancı madde olarak bulunur.
Sodyum, gümüşi beyaz renkli ve taze kesildiğinde parlak olan yumuşak, dövülebilir bir alkali metaldir (sodyumu bıçakla kesmek oldukça mümkündür). Basınç uygulandığında şeffaf kırmızı bir maddeye dönüşür, normal sıcaklıklarda kristalleşir. Hava ile etkileşime girdiğinde hızla oksitlenir, bu nedenle sodyumun bir kerosen tabakası altında depolanması gerekir.

Günlük sodyum ihtiyacı
Sodyum insan vücudu için önemli bir mikro elementtir; yetişkinler için günlük gereksinim 550 mg, çocuklar ve ergenler için - 500-1300 mg'dır. Hamilelik sırasında günlük sodyum normu 500 mg'dır ve bazı durumlarda (aşırı terleme, dehidrasyon, diüretik kullanımı) arttırılmalıdır.
Sodyum hemen hemen tüm deniz ürünlerinde (kerevit, yengeç, ahtapot, kalamar, midye, deniz yosunu), balıkta (hamsi, sardalye, pisi balığı, koku vb.), tavuk yumurtasında, tahıllarda (karabuğday, pirinç, inci arpa, yulaf ezmesi, darı) bulunur. ), baklagiller (bezelye, fasulye), sebzeler (domates, kereviz, havuç, lahana, pancar), süt ürünleri ve et yan ürünleri.

Sodyumun faydalı özellikleri ve vücut üzerindeki etkisi
Sodyumun vücut için faydalı özellikleri şunlardır:
- Su-tuz metabolizmasının normalleşmesi;
- Tükürük ve pankreas enzimlerinin aktivasyonu;
- Mide suyu üretimine katılım;
- Normal asit-baz dengesinin korunması;
- Sinir ve kas sisteminin fonksiyonlarını oluşturma;
- Vazodilatör etkisi;
- Kan ozmotik konsantrasyonunun korunması.
Sodyum sindirilebilirliği
Sodyum neredeyse tüm gıdalarda bulunur, ancak vücut sodyumun çoğunu (yaklaşık %80'ini) dışarıdan alır. Emilim esas olarak mide ve ince bağırsakta meydana gelir. sodyumun emilimini artırır, ancak aşırı tuzlu gıdalar ve protein açısından zengin gıdalar normal emilimi engeller.
Başkalarıyla etkileşim
Sodyum metalinin kullanımı, güçlü bir indirgeyici madde olarak görev yaptığı kimya ve metalurji endüstrilerindedir. Sodyum klorür (sofra tuzu) istisnasız gezegenimizin tüm sakinleri tarafından kullanılır, en ünlü tatlandırıcı ve en eski koruyucudur.

Sodyum eksikliği belirtileri
Sodyum eksikliği genellikle sıcak iklimlerde veya fiziksel aktivite sırasında aşırı terleme nedeniyle ortaya çıkar. Vücutta sodyum eksikliği, hafıza bozukluğu ve iştah kaybı, baş dönmesi, yorgunluk, dehidrasyon, kas zayıflığı ve bazen kramplar, deri döküntüleri, mide krampları, bulantı ve kusma ile karakterizedir.
Aşırı sodyum belirtileri
Vücutta aşırı miktarda sodyum bulunması, sürekli susuzluk, şişlik ve alerjik reaksiyonlarla kendini hissettirir.
Doğru, ampirik veya brüt formül: Hayır
Molekül ağırlığı: 22.99
Sodyum- birinci grubun bir elemanı (eski sınıflandırmaya göre - birinci grubun ana alt grubu), D.I. Mendeleev'in kimyasal elementlerinin periyodik sisteminin üçüncü periyodu, atom numarası 11 ile. Na (lat. Sodyum). Basit madde sodyum (CAS numarası: 7440-23-5), gümüşi beyaz renkte yumuşak bir alkali metaldir.
İsmin tarihi ve kökeni
Sodyum (veya daha doğrusu bileşikleri) eski çağlardan beri bilinmekte ve kullanılmaktadır. İncil'de Yeremya peygamberin kitabında eski Yunanca sözcüğünden bahsedilmektedir. νίτρον - Septuagint'te ve kelime Lat'tır. nitroet - Vulgata'da (Yer. 2:22) bir maddenin adı olarak, yağla karıştırılarak deterjan görevi gören bir tür soda veya potastır. Tanah'ta, eski Yunancadaki kelime. νίτρον eski İbraniceye karşılık gelir. ברית - “sabun” ve diğer İbranice. נתר - “kostik soda (sabunlu sıvı).” Soda (natron), Mısır'daki soda göllerinin sularında doğal olarak bulunur. Eski Mısırlılar, tuvalleri mumyalamak, ağartmak, yemek pişirmek, boya ve cila yapmak için doğal soda kullanıyorlardı. Yaşlı Pliny, Nil Deltası'nda sodanın (yeterli oranda safsızlık içeriyordu) nehir suyundan izole edildiğini yazıyor. Kömür karışımından dolayı gri ve hatta siyah renkli, büyük parçalar halinde satışa sunuldu.
"Sodyum" adı, Orta Mısır dilinden (nṯr) ödünç alınan Latince natrium kelimesinden (karş. eski Yunanca νίτρον) gelir ve burada diğer şeylerin yanı sıra "soda", "kostik soda" anlamına da gelir.
“Na” kısaltması ve natrium kelimesi ilk kez İsveç Hekimler Cemiyeti'nin kurucusu akademisyen Jöns Jakob Berzelius (1779-1848) tarafından sodayı da içeren doğal mineralleri belirtmek için kullanıldı. Daha önce (ve hala İngilizce, Fransızca ve diğer bazı dillerde), elemente sodyum (Latince sodyum) adı veriliyordu - bu sodyum adı muhtemelen soda kullanıldığı için Arapça "baş ağrısı" anlamına gelen suda kelimesine geri dönüyor. o zamanlar baş ağrısı ilacı olarak.
Sodyum ilk olarak İngiliz kimyager Humphry Davy tarafından elde edildi ve bunu 19 Kasım 1807'de Baker'ın dersinde bildirdi (dersin taslağında Davy, potasyumu 6 Ekim 1807'de ve sodyumu potasyumdan birkaç gün sonra keşfettiğini belirtti). erimiş sodyum hidroksitin elektrolizi ile.
Doğada olmak
Yer kabuğundaki sodyum Clarke miktarı 25 kg/t'tur. Deniz suyunun bileşik formundaki içeriği 10,5 g/l'dir. Sodyum metali, kaya tuzunu maviye boyayan bir safsızlık olarak oluşur. Tuz bu rengi radyasyonun etkisi altında alır.
Fiş
Sodyum üretmenin ilk endüstriyel yöntemi, sodyum karbonatın kömürle indirgenmesi reaksiyonuydu ve bu maddelerin yakın bir karışımını demir bir kapta 1000 °C'ye kadar ısıtıyordu (Deville yöntemi):
Na2C03 +2C → 2Na+3CO.
Kömür yerine kalsiyum karbür, alüminyum, silikon, ferrosilikon ve silikoalüminyum kullanılabilir.
Elektrik gücünün ortaya çıkmasıyla birlikte, sodyum üretmenin başka bir yöntemi daha pratik hale geldi: erimiş sodyum hidroksitin veya sodyum klorürün elektrolizi. Şu anda elektroliz, sodyum üretmenin ana yöntemidir.
Sodyum ayrıca zirkonyum termal yöntemiyle veya sodyum azidin termal ayrıştırılmasıyla da elde edilebilir.
Fiziki ozellikleri
Sodyum gümüşi beyaz bir metaldir, ince tabakalar halinde mor renkte, plastik, hatta yumuşak (bıçakla kolayca kesilebilir), taze kesilmiş sodyum parlaktır. Sodyumun elektriksel ve termal iletkenlikleri oldukça yüksektir, yoğunluğu 0,96842 g/cm³ (19,7 °C'de), erime noktası 97,86 °C, kaynama noktası 883,15 °C'dir.
Basınç altında yakut gibi şeffaf ve kırmızı olur.
Oda sıcaklığında sodyum kübik sistemde kristaller oluşturur, uzay grubu I m3m, hücre parametreleri a = 0,42820 nm, Z = 2.
−268 °C (5 K) sıcaklıkta, sodyum altıgen faza geçer, uzay grubu P 63/mmc, hücre parametreleri a = 0,3767 nm, c = 0,6154 nm, Z = 2.
Kimyasal özellikler
Bir alkali metal havada kolayca sodyum okside oksitlenir. Atmosferdeki oksijene karşı koruma sağlamak için sodyum metali bir gazyağı tabakası altında depolanır.
4Na+O2 → 2Na2O
Havada veya oksijende yakıldığında sodyum peroksit oluşur:
2Na+O2 → Na202
Ayrıca sodyum ozonit NaO3 vardır.
Sodyum suyla çok şiddetli reaksiyona girer; suya konulan bir sodyum parçası, oluşan ısı nedeniyle yukarı doğru yüzer, erir, su yüzeyinde farklı yönlere hızla hareket eden beyaz bir top haline gelir; salınımıyla reaksiyon meydana gelir. tutuşabilen hidrojen. Reaksiyon denklemi:
2Na+2H20 → 2NaOH +H2
Tüm alkali metaller gibi, sodyum da güçlü bir indirgeyici maddedir ve birçok metal olmayan maddeyle (nitrojen, iyot, karbon, soy gazlar hariç) güçlü bir şekilde reaksiyona girer:
2Na+Cl 2 → 2NaCl
2Na+H 2 → 2NaH
Sodyum lityumdan daha aktiftir. Kızdırma deşarjında nitrojenle son derece zayıf reaksiyona girerek çok kararsız bir madde oluşturur - sodyum nitrür (kolayca oluşan lityum nitrürün aksine):
6Na+N 2 → 2Na3N
Sıradan metal gibi seyreltilmiş metallerle etkileşime girer:
2Na+2HCl → 2NaCl+H2
Konsantre oksitleyici asitlerle indirgeme ürünleri açığa çıkar:
8Na+10HNO3 → 8NaNO3 +NH4 NO3 +3H2O
Sıvı amonyakta çözünerek mavi bir çözelti oluşturur:
Na+4NH3 → Na(NH3) 4
Isıtıldığında amonyak gazıyla reaksiyona girer:
2Na+2NH3 → 2NaNH2 +H2
Cıva ile saf metal yerine daha yumuşak bir indirgeyici madde olarak kullanılan sodyum amalgamı oluşturur. Potasyumla birleştirildiğinde sıvı bir alaşım üretir.
Fazla metal içeren alkil halojenürler, genellikle havada kendiliğinden tutuşan ve suyla patlayan oldukça reaktif bileşikler olan organosodyum bileşikleri üretebilir. Metal eksikliği olduğunda Wurtz reaksiyonu meydana gelir.
Organik çözücülerin varlığında taç eterlerde çözünür ve bir elektrit veya alkalid verir (ikincisinde sodyumun alışılmadık bir oksidasyon durumu -1 vardır).
Başvuru
Sodyum metali, metalurji de dahil olmak üzere preparatif kimya ve endüstride güçlü bir indirgeyici madde olarak yaygın şekilde kullanılmaktadır. Eter gibi organik solventlerin kurutulmasında kullanılır. Sodyum, yüksek enerji yoğunluğuna sahip sodyum-sülfür pillerin üretiminde kullanılır. Ayrıca kamyon motorlarının egzoz valflerinde sıvı soğutucu olarak kullanılır. Bazen, çok yüksek akımları taşıması amaçlanan elektrik kabloları için malzeme olarak sodyum metali kullanılır.
Potasyumun yanı sıra rubidyum ve sezyum içeren bir alaşımda yüksek verimli bir soğutucu olarak kullanılır. Özellikle, %12 sodyum, %47 potasyum, %41 sezyum bileşiminden oluşan alaşım -78 °C gibi rekor derecede düşük bir erime noktasına sahiptir ve iyon roket motorları için çalışma sıvısı ve nükleer enerji santralleri için soğutucu olarak önerilmiştir.
Hızlı nötron nükleer reaktörleri BN-600 ve BN-800'deki sıvı metal soğutucu.
Sodyum ayrıca yüksek ve düşük basınçlı deşarj lambalarında (HPLD ve LPLD) kullanılır. DNaT (Arc Sodium Tubular) tipi NLVD lambalar sokak aydınlatmasında çok yaygın olarak kullanılmaktadır. Parlak sarı bir ışık yayarlar. HPS lambaların kullanım ömrü 12-24 bin saattir. Bu nedenle HPS tipi gaz deşarjlı lambalar kentsel, mimari ve endüstriyel aydınlatmanın vazgeçilmezidir. Ayrıca DNaS, DNaMT (Ark Sodyum Mat), DNaZ (Ark Sodyum Ayna) ve DNaTBR (Cıvasız Ark Sodyum Borulu) lambalar da vardır.
Kalitatif analizde sodyum metali kullanılır. Sodyum ve test maddesinden oluşan alaşım etanol ile nötralize edilir, birkaç mililitre damıtılmış su eklenir ve 3 parçaya bölünür, J. Lassaigne testi (1843) nitrojen, kükürt ve halojenleri (Beilstein testi) belirlemeyi amaçlamaktadır.
Sodyum klorür (sofra tuzu) en eski kullanılan tatlandırıcı ve koruyucudur.
Sodyum azit (NaN3), metalurjide ve kurşun azit üretiminde nitrürleme maddesi olarak kullanılır.
Sodyum siyanür (NaCN), hidrometalurjik yöntemle altının kayalardan ayrıştırılmasında, ayrıca çeliğin nitrokarbürizasyonunda ve elektrokaplamada (gümüşleme, yaldızlama) kullanılır.
Sodyum klorat (NaClO 3), demiryolu raylarındaki istenmeyen bitki örtüsünü yok etmek için kullanılır.
Sodyum izotopları
Şu anda (2012) kütle numaraları 18'den 37'ye kadar olan 20 izotop ve sodyumun 2 nükleer izomeri bilinmektedir. Tek kararlı izotop 23Na'dır. Çoğu izotopun yarı ömrü bir dakikadan kısadır; yalnızca 2 radyoaktif izotopun (22Na ve 24Na) yarı ömrü daha uzundur. 22Na, 2.6027 yıllık yarılanma ömrüyle pozitron bozunmasına uğrar ve pozitron kaynağı olarak ve bilimsel araştırmalarda kullanılır. 15 saatlik β− bozunma yarı ömrüne sahip 24Na, tıpta bazı lösemi türlerinin tanı ve tedavisinde kullanılır.
Biyolojik rol
Sodyum tüm canlı organizmaların bir parçasıdır. Yüksek organizmalarda sodyum çoğunlukla hücrelerin hücreler arası sıvısında bulunur (hücrenin sitoplazmasındakinden yaklaşık 15 kat daha fazla). Konsantrasyon farkı, hücre zarına yerleştirilmiş sodyum-potasyum pompasını korur ve sodyum iyonlarını sitoplazmadan hücreler arası sıvıya pompalar.
Potasyum ile birlikte sodyum aşağıdaki işlevleri yerine getirir:
- Membran potansiyeli ve kas kasılmalarının oluşması için koşullar yaratmak.
- Kan ozmotik konsantrasyonunun korunması.
- Asit-baz dengesinin korunması.
- Su dengesinin normalleştirilmesi.
- Membran taşınmasının sağlanması.
- Birçok enzimin aktivasyonu.
Sodyum hemen hemen tüm ürünlerde değişen miktarlarda bulunur, ancak vücut çoğunu konserve yiyecekler, yarı mamul ürünler, soslar, sosisler vb. dahil olmak üzere sofra tuzundan alır. Diğer diyet sodyum kaynakları arasında monosodyum glutamat, kabartma tozu (sodyum bikarbonat), sodyum nitrit, sodyum sakarinat ve sodyum benzoat bulunur. Emilim esas olarak mide ve ince bağırsakta meydana gelir. D vitamini sodyum emilimini artırır ancak aşırı tuzlu gıdalar ve protein açısından zengin gıdalar normal emilimi engeller. Yiyeceklerden alınan sodyum miktarı idrardaki sodyum içeriğini gösterir. Sodyum açısından zengin gıdalar, hızlandırılmış atılımla karakterize edilir.
Dengeli beslenen bir insanda sodyum eksikliği oluşmaz ancak oruç sırasında bazı sorunlar ortaya çıkabilir. Geçici eksikliğin nedeni idrar söktürücü kullanımı, ishal, aşırı terleme veya aşırı su alımı olabilir.
Sodyum eksikliğinin belirtileri arasında kilo kaybı, kusma, gastrointestinal sistemde gaz oluşumu ve amino asitlerin ve monosakkaritlerin emiliminin bozulması yer alır. Uzun süreli eksiklik kas kramplarına ve nevraljiye neden olur.
Çok fazla sodyum, bacaklarda ve yüzde şişmeye, idrarda potasyum atılımının artmasına ve bazı kişilerde yüksek tansiyona ve sıvı tutulmasına neden olur. Böbreklerin işleyebileceği maksimum tuz miktarı yaklaşık 20-30 gramdır; daha fazlası hayati tehlike oluşturur.
İhtiyati önlemler
Laboratuvarlarda az miktarda sodyum (yaklaşık 1 kg'a kadar) kapalı cam kavanozlarda bir gazyağı tabakası altında depolanır, böylece gazyağı tüm metali kaplar. Sodyum kavanozu metal yanmaz bir dolapta (kasa) saklanmalıdır. Sodyum cımbız veya maşa ile alınır, neşterle kesilir (sodyum plastiktir ve bıçakla kolayca kesilebilir) kuru bir yüzeyde (masa üzerinde değil, cam bir bardakta), gereken miktar ve geri kalanı hemen bir gazyağı tabakası altında kavanoza geri gönderilir ve kesilen parça ya gazyağı içine yerleştirilir ya da hemen reaksiyona sokulur. Sodyumla çalışmaya başlamadan önce güvenlik eğitiminden geçmelisiniz; Sodyumla ilk kez çalışmaya başlayacak kişilerin, bu işi bu konuda tecrübeli çalışanların gözetiminde yapmaları gerekmektedir. Tipik olarak laboratuvar koşullarında, reaksiyonlar için birkaç on gramı aşmayan miktarlarda sodyum kullanılır. Örneğin okul kimya derslerinde gösteri deneyleri için bir gramdan fazla sodyum almamalısınız. Metalik sodyum ile çalıştıktan sonra tüm kaplar ve sodyum kalıntıları seyreltilmemiş alkolle dökülür ve elde edilen çözelti zayıf bir asit çözeltisiyle nötrleştirilir. Çöp kutusundaki sodyum yangına neden olabileceğinden ve kanalizasyon drenajında borunun patlamasına neden olabileceğinden, tüm sodyum kalıntılarının ve artıkların atılmadan önce tamamen nötralize edildiğinden emin olmak için özel dikkat gösterilmelidir. Sodyumla ve genel olarak alkaliler ve alkali metallerle yapılan tüm çalışmalar gözlük veya koruyucu maske takılarak yapılmalıdır. Sodyumun evde saklanması veya onunla herhangi bir deney yapılması önerilmez.
Sodyum metalinin su ve birçok organik bileşikle teması halinde tutuşması ve hatta patlaması ciddi yaralanmalara ve yanıklara neden olabilir. Çıplak elle bir parça sodyum metali almaya çalışmak, ciltteki nem nedeniyle parçanın tutuşmasına (bazen patlamasına) neden olarak ciddi sodyum yanıklarına ve bunun sonucunda yanıklara neden olabilir. Sodyumun yanması, aşındırıcı olan bir sodyum oksit, peroksit ve hidroksit aerosolü oluşturur. Sodyumun bazı reaksiyonları çok şiddetli gerçekleşir (örneğin kükürt, brom ile).
| Sodyum | |
|---|---|
| Atomik numara | 11 |
| Basit bir maddenin görünümü | gümüş-beyaz yumuşak metal |
| Atomun özellikleri | |
| Atom kütlesi (molar kütle) |
22.989768 a. e.m. (/ mol) |
| Atom yarıçapı | 190:00 |
| İyonlaşma enerjisi (ilk elektron) |
495,6(5,14) kJ/mol (eV) |
| Elektronik konfigürasyon | 3'ler 1 |
| Kimyasal özellikler | |
| Kovalent yarıçap | 154:00 |
| İyon yarıçapı | 97 (+1e) öğleden sonra |
| Elektronegatiflik (Pauling'e göre) |
0,93 |
| Elektrot potansiyeli | -2,71V |
| Oksidasyon durumları | 1 |
| Basit bir maddenin termodinamik özellikleri | |
| Yoğunluk | 0,971 /cm³ |
| Molar ısı kapasitesi | 28,23 J/(mol) |
| Termal iletkenlik | 142,0 W/(·) |
| Erime sıcaklığı | 370,96 |
| Erime Isısı | 2,64 kJ/mol |
| Kaynama sıcaklığı | 1156,1 |
| Buharlaşma ısısı | 97,9 kJ/mol |
| Molar hacim | 23,7 cm³/mol |
| Basit bir maddenin kristal kafesi | |
| Kafes yapısı | kübik vücut merkezli |
| Kafes parametreleri | 4,230 |
| c/a oranı | — |
| Debye sıcaklığı | 150 bin |
| Hayır | 11 |
| 22,98977 | |
| 3'ler 1 | |
| Sodyum | |
Sodyum —eleman birinci grubun ana alt grubu, D.I. Mendeleev'in kimyasal elementlerinin periyodik sisteminin üçüncü periyodu, atom numarası 11 ile. Na (lat. Natrium) sembolü ile gösterilir. Basit madde sodyum (CAS numarası: 7440-23-5), gümüşi beyaz renkte yumuşak bir alkali metaldir.
Suda sodyum, lityum ile hemen hemen aynı şekilde davranır: reaksiyon, hidrojenin hızlı salınımıyla ilerler ve çözeltide sodyum hidroksit oluşur.
İsmin tarihi ve kökeni
Sodyum (veya daha doğrusu bileşikleri) eski çağlardan beri kullanılmaktadır. Örneğin Mısır'daki soda göllerinin sularında doğal olarak bulunan soda (natron). Eski Mısırlılar, tuvalleri mumyalamak, ağartmak, yemek pişirmek, boya ve cila yapmak için doğal soda kullanıyorlardı. Yaşlı Pliny, Nil Deltası'nda sodanın (yeterli oranda safsızlık içeriyordu) nehir suyundan izole edildiğini yazıyor. Kömür karışımından dolayı gri ve hatta siyah renkli, büyük parçalar halinde satışa sunuldu.
Sodyum ilk kez 1807 yılında İngiliz kimyager Humphry Davy tarafından katı NaOH'ın elektrolizi ile elde edildi.
"Sodyum" ismi Arapça'dan gelmektedir. natrun Yunanca'da - nitron ve başlangıçta doğal sodaya atıfta bulunuyordu. Elementin kendisi daha önce Sodyum olarak adlandırılıyordu.
Fiş
Sodyum üretmenin ilk yolu indirgeme reaksiyonuydu sodyum karbonat Bu maddelerin yakın bir karışımını demir bir kapta 1000°C'ye ısıtırken kömür:
Na2C03 +2C=2Na+3CO
Daha sonra başka bir sodyum üretme yöntemi ortaya çıktı - erimiş sodyum hidroksitin veya sodyum klorürün elektrolizi.
Fiziki ozellikleri
Gazyağı içinde depolanan metalik sodyum

“Sodyum D-çizgisi”nin emisyon spektrumunun alev - parlak sarı rengini, çift 588.9950 ve 589.5924 nm'yi kullanarak sodyumun kalitatif tespiti.
Sodyum gümüşi beyaz bir metaldir, ince tabakalar halinde mor renkte, plastik, hatta yumuşak (bıçakla kolayca kesilebilir), taze kesilmiş sodyum parlaktır. Sodyumun elektriksel ve termal iletkenlik değerleri oldukça yüksek, yoğunluğu 0,96842 g/cm³ (19,7°C'de), erime noktası 97,86°C, kaynama noktası 883,15°C'dir.
Kimyasal özellikler
Havada kolayca oksitlenen bir alkali metal. Atmosferdeki oksijene karşı koruma sağlamak için metalik sodyum bir tabakanın altında depolanır. gazyağı. Sodyum daha az aktiftir lityum, dolayısıyla azot yalnızca ısıtıldığında tepki verir:
2Na + 3N2 = 2NaN3
Çok fazla oksijen olduğunda sodyum peroksit oluşur
2Na + O2 = Na202
Başvuru
Sodyum metali, metalurji de dahil olmak üzere preparatif kimyada ve endüstride güçlü bir indirgeyici madde olarak yaygın olarak kullanılmaktadır. Sodyum, yüksek enerji yoğunluğuna sahip sodyum-sülfür pillerin üretiminde kullanılır. Ayrıca kamyon egzoz valflerinde soğutucu olarak da kullanılır. Bazen, çok yüksek akımları taşıması amaçlanan elektrik kabloları için malzeme olarak sodyum metali kullanılır.
Potasyumlu bir alaşımın yanı sıra rubidyum ve sezyum Yüksek verimli bir soğutucu olarak kullanılır. Özellikle alaşım bileşimi %12 sodyumdur, potasyum 47 %, sezyum%41'in -78 °C gibi rekor derecede düşük bir erime noktası vardır ve iyon roket motorları için çalışma sıvısı ve nükleer enerji santralleri için soğutucu olarak önerilmiştir.
Sodyum ayrıca yüksek ve düşük basınçlı deşarj lambalarında (HPLD ve LPLD) kullanılır. DNaT (Arc Sodium Tubular) tipi NLVD lambalar sokak aydınlatmasında çok yaygın olarak kullanılmaktadır. Parlak sarı bir ışık yayarlar. HPS lambaların kullanım ömrü 12-24 bin saattir. Bu nedenle HPS tipi gaz deşarjlı lambalar kentsel, mimari ve endüstriyel aydınlatmanın vazgeçilmezidir. Ayrıca DNaS, DNaMT (Ark Sodyum Mat), DNaZ (Ark Sodyum Ayna) ve DNaTBR (Cıvasız Ark Sodyum Borulu) lambalar da vardır.
Organik maddenin kalitatif analizinde sodyum metali kullanılır. Sodyum ve test maddesinin alaşımı nötralize edilir etanol, birkaç mililitre damıtılmış su ekleyin ve 3 parçaya bölün, J. Lassaigne testi (1843), nitrojen, kükürt ve halojenleri belirlemeyi amaçlamaktadır (Beilstein testi)
— Sodyum klorür (sofra tuzu) kullanılan en eski tatlandırıcı ve koruyucudur.
— Sodyum azit (Na 3 N), metalurjide ve kurşun azit üretiminde nitrürleme maddesi olarak kullanılır.
— Sodyum siyanür (NaCN), hidrometalurjik yöntemle altının kayalardan ayrıştırılmasında, ayrıca çeliğin nitrokarbürizasyonunda ve elektrokaplamada (gümüşleme, yaldızlama) kullanılır.
— Sodyum klorat (NaClO 3), demiryolu raylarındaki istenmeyen bitki örtüsünü yok etmek için kullanılır.
Biyolojik rol
Vücutta sodyum çoğunlukla hücrelerin dışında bulunur (sitoplazmadakinden yaklaşık 15 kat daha fazla). Bu fark, hücre içinde sıkışan sodyumu dışarı pompalayan sodyum-potasyum pompası tarafından korunur.
Birliktepotasyumsodyum aşağıdaki işlevleri yerine getirir:
Membran potansiyeli ve kas kasılmalarının oluşması için koşullar yaratmak.
Kan ozmotik konsantrasyonunun korunması.
Asit-baz dengesinin korunması.
Su dengesinin normalleştirilmesi.
Membran taşınmasının sağlanması.
Birçok enzimin aktivasyonu.
Sodyum hemen hemen tüm gıdalarda bulunur, ancak vücut sodyumun çoğunu sofra tuzundan alır. Emilim esas olarak mide ve ince bağırsakta meydana gelir. D vitamini sodyumun emilimini artırır, ancak aşırı tuzlu gıdalar ve protein açısından zengin gıdalar normal emilimi engeller. Yiyeceklerden alınan sodyum miktarı idrardaki sodyum içeriğini gösterir. Sodyum açısından zengin gıdalar, hızlandırılmış atılımla karakterize edilir.
Diyet yapanlarda sodyum eksikliği dengeli gıda insanlarda görülmez ancak vejetaryen beslenmede bazı sorunlar ortaya çıkabilir. Geçici eksikliğin nedeni idrar söktürücü kullanımı, ishal, aşırı terleme veya aşırı su alımı olabilir. Sodyum eksikliğinin belirtileri arasında kilo kaybı, kusma, gastrointestinal sistemde gaz ve emilim bozukluğu yer alır. Amino asitler ve monosakkaritler. Uzun süreli eksiklik kas kramplarına ve nevraljiye neden olur.
Aşırı sodyum, bacakların ve yüzün şişmesine ve ayrıca idrarla potasyum atılımının artmasına neden olur. Böbreklerin işleyebileceği maksimum tuz miktarı yaklaşık 20-30 gramdır; daha fazlası hayati tehlike oluşturur.
Sodyum bileşikleri
Sodyum, Natrium, Na (11)
Sodyum - sodyum, sodyum adı, Mısır'da, eski Yunanlılar (vixpov) ve Romalılar arasında yaygın olan eski bir kelimeden gelir. Pliny (Nitron) ve diğer eski yazarlarda bulunur ve İbranice neter'e karşılık gelir. Eski Mısır'da, natron veya nitron genellikle yalnızca doğal soda göllerinden değil aynı zamanda bitki külünden de elde edilen bir alkali olarak adlandırılıyordu. Yıkamak, sır yapmak ve cesetleri mumyalamak için kullanıldı. Orta Çağ'da nitron (nitron, natron, nataron) ve bor (baurach) adı güherçile (Nitrum) için de kullanılıyordu. Arap simyacıları alkali alkali adını verdiler. Avrupa'da barutun keşfiyle birlikte güherçile (Sal Petrae) alkalilerden kesin olarak ayrılmaya başladı ve 17. yüzyılda. uçucu olmayan veya sabit alkaliler ile uçucu alkali (uçucu alkali) arasında zaten ayrım yapılmıştır. Aynı zamanda bitkisel (Alkali fixum vegetabile - potash) ile mineral alkali (Alkali fixum minerale - soda) arasında da fark belirlendi.
18. yüzyılın sonunda. Klaproth, mineral alkali için Natron veya soda ve bitkisel alkali için Kali adını verdi. Lavoisier, alkalileri "Basit Cisimler Tablosu"na yerleştirmedi ve bir notunda bunların bir zamanlar muhtemelen karmaşık maddeler olduğunu belirtti. Bir gün çürüyecekler. Aslında, 1807'de Davy, hafifçe nemlendirilmiş katı alkalilerin elektrolizi yoluyla serbest metaller elde etti - potasyum ve sodyum, bunlara potasyum ve sodyum adını verdi. Ertesi yıl, ünlü Annals of Physics'in yayıncısı Gilbert, yeni metallere potasyum ve sodyum (Natronyum) adını vermeyi önerdi; Berzelius ikinci adı “sodyum” (Natrium) olarak kısalttı. 19. yüzyılın başında. Rusya'da sodyuma soda adı verildi (Dvigubsky, 182i; Solovyov, 1824); Strakhov çim adını önerdi (1825). Sodyum tuzlarına örneğin soda sülfat, hidroklorik soda ve aynı zamanda asetik soda adı verildi (Dvigubsky, 1828). Hess, Berzelius örneğini takip ederek sodyum adını tanıttı.
Sodyum (Latince Natrium, Na ile sembolize edilir), atom numarası 11 ve atom ağırlığı 22.98977 olan bir elementtir. Dmitry Ivanovich Mendeleev'in periyodik kimyasal elementler sisteminin üçüncü dönemi olan birinci grubun ana alt grubunun bir unsurudur. Basit madde sodyum, yumuşak, eriyebilir (erime 97,86 °C), esnek, hafif (yoğunluk 0,968 g/cm3), gümüş-beyaz renkli alkali metaldir.
Doğal sodyum, kütle numarası 23 olan tek bir izotoptan oluşur. Şu anda toplam 15 izotop ve 2 nükleer izomer bilinmektedir. Yapay olarak üretilen radyoaktif izotopların çoğunun yarı ömrü bir dakikadan azdır. Yalnızca iki izotopun yarı ömrü nispeten uzundur: pozitron kaynağı olarak ve bilimsel araştırmalarda kullanılan, yarı ömrü 2,6 yıl olan pozitron yayan 22Na ve yarı ömrü 15 saat olan 24Na. Tıpta bazı lösemi türlerinin tanı ve tedavisinde kullanılır.
Sodyumun çeşitli bileşikler halinde olduğu eski çağlardan beri bilinmektedir. Sodyum klorür (NaCl) veya sofra tuzu en önemli hayati bileşiklerden biridir; Neolitik dönemde insan tarafından bilindiğine inanılmaktadır, yani insanlığın altı bin yıldan fazla bir süredir sodyum klorür tükettiği ortaya çıkmaktadır. ! Eski Ahit'te "neter" adı verilen bir maddenin deterjan olarak kullanıldığı belirtiliyor. Büyük ihtimalle Mısır'daki tuz göllerinin sularında bulunan bir sodyum karbonat olan sodadır.
18. yüzyılda kimyagerler çok sayıda sodyum bileşiğini zaten biliyorlardı; bu metalin tuzları tıpta ve tekstil endüstrisinde (kumaşları boyamak ve deriyi tabaklamak için) yaygın olarak kullanılıyordu. Ancak metalik sodyum ancak 1807'de İngiliz kimyager Humphry Davy tarafından elde edildi.
Sodyumun en önemli uygulama alanları nükleer enerji, metalurji ve organik sentez endüstrisidir. Nükleer enerjide, sıvı metal soğutucu olarak sodyum ve potasyum ile alaşımı kullanılır. Metalurjide, sodyum metal yöntemiyle bir dizi refrakter metal elde edilir; KOH'nin sodyum ile indirgenmesiyle potasyum izole edilir. Ayrıca kurşun alaşımlarını güçlendiren katkı maddesi olarak sodyum kullanılır. Organik sentez endüstrisinde birçok maddenin üretiminde sodyum kullanılmaktadır. Sodyum, bazı organik polimerlerin üretiminde katalizör görevi görür. En önemli sodyum bileşikleri sodyum oksit Na2O, sodyum peroksit Na2O2 ve sodyum hidroksit NaOH'dir. Sodyum peroksit, kumaşların ağartılmasında ve izole odalarda hava rejenerasyonu için kullanılır. Sodyum hidroksit, temel kimya endüstrisinin en önemli ürünlerinden biridir. Petrol ürünlerini saflaştırmak için muazzam miktarlarda tüketilir. Ayrıca sodyum hidroksit sabun, kağıt, tekstil ve diğer endüstrilerin yanı sıra suni elyaf üretiminde de yaygın olarak kullanılmaktadır.
Sodyum, hayvanların ve insanların mineral metabolizmasında yer alan en önemli elementlerden biridir. İnsan vücudunda, çözünebilir tuzlar (klorür, fosfat, bikarbonat) formundaki sodyum, esas olarak hücre dışı sıvılarda - kan plazması, lenf, sindirim sularında bulunur. Kan plazmasının ozmotik basıncı, öncelikle sodyum klorür nedeniyle gerekli seviyede tutulur.
Sodyum eksikliğinin belirtileri arasında kilo kaybı, kusma, gastrointestinal sistemde gaz oluşumu ve amino asitlerin ve monosakkaritlerin emiliminin bozulması yer alır. Uzun süreli eksiklik kas kramplarına ve nevraljiye neden olur. Aşırı sodyum, bacakların ve yüzün şişmesine ve ayrıca idrarla potasyum atılımının artmasına neden olur.
Biyolojik özellikler
Sodyum, mikro elementlerle birlikte hayvanların ve insanların mineral metabolizmasında önemli rol oynayan makro elementler grubuna aittir. Makroelementler vücutta, vücut ağırlığının ortalama %0,1 ila 0,9'u kadar önemli miktarlarda bulunur. Bir yetişkinin vücudundaki sodyum içeriği 70 kg ağırlık başına 55-60 g'dır. Onbir numaralı element esas olarak hücre dışı sıvılarda bulunur: kanda - 160-240 mg, plazmada - 300-350 mg, kırmızı kan hücrelerinde - 50-130 mg. Kemik dokusu 180 mg'a kadar sodyum içerir, diş minesi bu makroelement açısından çok daha zengindir - 250 mg. Akciğerlerde 250 mg'a kadar, kalpte ise 185 mg'a kadar sodyum konsantre olur. Kas dokusu yaklaşık 75 mg sodyum içerir.
Sodyumun insan, hayvan ve hatta bitki vücudundaki temel işlevi hücrelerdeki su-tuz dengesini korumak, ozmotik basıncı ve asit-baz dengesini düzenlemektir. Bu nedenle bitki hücrelerindeki sodyum içeriği oldukça yüksektir (ıslak ağırlığın yaklaşık %0,01'i); sodyum, hücre özsuyunda yüksek ozmotik basınç oluşturarak suyun topraktan çekilmesine katkıda bulunur. İnsan ve hayvan vücudunda sodyum, nöromüsküler aktivitenin normalleşmesinden sorumludur (sinir uyarılarının normal iletilmesine katılır) ve kandaki temel mineralleri çözünmüş halde tutar. Genel olarak, sodyumun metabolizmayı düzenlemedeki rolü çok daha geniştir çünkü bu element vücudun normal büyümesi ve durumu için gereklidir. Sodyum, kan şekeri gibi çeşitli maddeleri her hücreye ileten bir “kurye” görevi görür. Isı veya güneş çarpmasının oluşmasını önler ve ayrıca belirgin bir damar genişletici etkiye sahiptir.
Sodyum diğer elementlerle aktif olarak etkileşime girer, böylece klor ile birlikte sıvının kan damarlarından bitişik dokulara sızmasını önler. Bununla birlikte, sodyumun ana "ortağı", yukarıdaki işlevlerin çoğunu birlikte gerçekleştirdikleri potasyumdur. Çocuklar için optimal günlük sodyum dozu 600 ila 1.700 miligram, yetişkinler için ise 1.200 ila 2.300 miligram arasındadır. Sofra tuzu eşdeğerinde (en popüler ve erişilebilir sodyum kaynağı) bu, günde 3-6 grama karşılık gelir (100 gram sofra tuzu, 40 gram sodyum içerir). Günlük sodyum ihtiyacı esas olarak ter yoluyla kaybedilen tuz miktarına bağlıdır ve 10 grama kadar NaCl olabilir. Sodyum hemen hemen tüm gıdalarda bulunur (önemli miktarlarda çavdar ekmeği, tavuk yumurtası, sert peynir, sığır eti ve sütte), ancak vücut çoğunu sofra tuzundan alır. On birinci elementin emilimi esas olarak midede ve ince bağırsakta meydana gelir; D vitamini, sodyumun daha iyi emilmesini sağlar. Aynı zamanda protein açısından zengin ve özellikle tuzlu besinler emilim güçlüğüne yol açabilir. Vücuttaki sodyum iyonlarının konsantrasyonu esas olarak adrenal korteks hormonu - aldosteron tarafından düzenlenir, kişinin sodyumu kötüye kullanmasına veya yeterince sodyum almamasına bağlı olarak böbrekler sodyumu tutar veya serbest bırakır. Bu nedenle normal dış koşullar ve uygun böbrek fonksiyonu altında ne sodyum eksikliği ne de fazlalığı meydana gelebilir. Bu elementin eksikliği bazı vejetaryen diyetlerde ortaya çıkabilir. Ayrıca ağır fiziksel mesleklerde çalışanlar ve sporcular ter yoluyla ağır sodyum kaybına uğrarlar. Aşırı terleme, kusma ve ishalin eşlik ettiği çeşitli zehirlenmelerde de sodyum eksikliği mümkündür. Ancak böyle bir dengesizlik, vücudun yalnızca sodyumu değil aynı zamanda belirli miktarda diğer mineral tuzlarını (potasyum, klor ve lityum) aldığı maden suyuyla kolayca düzeltilebilir.
Sodyum eksikliği (hiponatremi) ile birlikte iştahsızlık, tat alma duyusunda azalma, mide krampları, bulantı, kusma, gaz oluşumu gibi belirtiler ortaya çıkar ve tüm bunların sonucunda ciddi kilo kaybı meydana gelir. Uzun süreli eksiklik kas kramplarına ve nevraljiye neden olur: Hasta yürürken dengede zorluk yaşayabilir, baş dönmesi ve yorgunluk yaşayabilir ve şok durumu oluşabilir. Sodyum eksikliğinin belirtileri arasında hafıza sorunları, ani ruh hali değişiklikleri ve depresyon da yer alır.
Sodyumun fazlalığı vücutta su tutulmasına neden olur, bu da kan yoğunluğunun artmasına, dolayısıyla kan basıncının artmasına (hipertansiyon), ödem ve damar hastalığına neden olur. Ayrıca fazla sodyum idrarla potasyum atılımının artmasına neden olur. Böbreklerin işleyebileceği maksimum tuz miktarı yaklaşık 20-30 gramdır; daha fazlası hayati tehlike oluşturur!
Tıpta çok sayıda sodyum preparatı kullanılmaktadır, en yaygın kullanılanlar sodyum sülfat, klorürdür (kan kaybı, sıvı kaybı, kusma için); tiyosülfat Na2S2O3∙5H2O (anti-inflamatuar ve antitoksik madde); borat Na2B4O7∙10H2O (antiseptik); bikarbonat NaHCO3 (balgam söktürücü olarak ve ayrıca rinit, larenjit için yıkama ve durulama için).
Vazgeçilmez ve değerli bir gıda baharatı olan sofra tuzu, eski çağlardan beri biliniyordu. Günümüzde sodyum klorür, kömür, kireçtaşı ve kükürt ile birlikte ucuz bir üründür ve kimya endüstrisi için en önemli olan "dört büyük" mineral hammaddesinden biridir. Ancak tuzun fiyatının altınla eşit olduğu zamanlar da vardı. Örneğin, eski Roma'da lejyonerlere genellikle parayla değil tuzla ödeme yapılırdı, dolayısıyla asker kelimesi de buradan gelir. Kiev Rus'a Karpat bölgesinden, ayrıca tuz göllerinden ve Kara ve Azak denizlerinin haliçlerinden tuz teslim edildi. Çıkarılması ve teslimatı o kadar pahalıydı ki, tören ziyafetlerinde yalnızca soylu misafirlerin sofralarında servis edilirken, diğerleri "höpürerek" uzaklaşıyorlardı. Hazar bölgesindeki tuz gölleriyle birlikte Astrahan krallığının Rusya'ya ilhak edilmesinden sonra bile tuz fiyatlarının düşmemesi, nüfusun en yoksul kesimleri arasında hoşnutsuzluğa neden oldu ve bu durum, "İslam Devrimi" olarak bilinen bir ayaklanmaya dönüştü. Tuz İsyanı (1648). Peter I, 1711'de stratejik açıdan önemli bir hammadde olan tuz ticaretinde tekel oluşturdu; devlete özel tuz ticareti hakkı 1862'ye kadar sürdü. Misafirleri “ekmek ve tuzla” karşılama geleneği hâlâ korunuyor, bu da evdeki en değerli şeyin paylaşılması anlamına geliyordu.
Herkes şu ifadeyi çok iyi biliyor: "Bir insanı tanımak için onunla yarım kilo tuz yemelisiniz", ancak çok az kişi bu cümlenin anlamını düşünmüştür. Bir kişinin yılda 8 kilograma kadar sodyum klorür tükettiği tahmin edilmektedir. Sloganın yalnızca bir yılı ima ettiği ortaya çıktı - sonuçta, bu dönemde iki kişi bir pound tuzu (16 kg) yenebilir.
Sodyumun elektriksel iletkenliği bakırın elektriksel iletkenliğinden üç kat daha düşüktür. Bununla birlikte, sodyum dokuz kat daha hafiftir, bu nedenle, eğer mevcut olsaydı, sodyum tellerinin bakır tellerden daha ucuza mal olacağı ortaya çıktı. Doğru, yüksek akımlar için tasarlanmış sodyum dolu çelik baralar var.
Dünya Okyanuslarındaki sodyum klorür içeriğine eşdeğer miktardaki kaya tuzunun 19 milyon metreküp hacim kaplayacağı tahmin ediliyor. km (Kuzey Amerika kıtasının deniz seviyesinin üzerindeki toplam hacminden% 50 daha fazla). Taban alanı 1 km2 olan bu hacimdeki bir prizma, Ay'a 47 kez ulaşabilir! Deniz sularından elde edilen tuz, yerkürenin tüm kara kütlesini 130 m'lik bir katmanla kaplayabilir! Artık deniz suyundan toplam sodyum klorür üretimi yılda 6-7 milyon tona ulaştı, bu da toplam dünya üretiminin yaklaşık üçte biri.
Sodyum peroksit karbondioksitle reaksiyona girdiğinde solunumun tersi olan bir işlem meydana gelir:
2Na2O2 + 2CO2 → 2Na2CO3 + O2
Reaksiyon sırasında karbondioksit bağlanır ve oksijen açığa çıkar. Bu reaksiyon, havanın yenilenmesi için denizaltılarda uygulama alanı buldu.
Kanadalı bilim adamları tarafından ilginç bir gerçek tespit edildi. Çabuk sinirlenen ve asabi insanlarda sodyumun vücuttan hızla atıldığını buldular. Sakin ve dost canlısı insanlar ile sevgililer gibi olumlu duygular yaşayanlar bu maddeyi iyi emer.
Sodyumun yardımıyla 3 Ocak 1959'da Ay'a doğru uçan bir Sovyet uzay aracından sodyum buharının uzaya fırlatılmasıyla Dünya'dan 113 bin km uzaklıkta yapay bir kuyruklu yıldız oluşturuldu. Sodyum kuyruklu yıldızının parlak parıltısı, Dünya-Ay rotası boyunca geçen ilk uçağın yörüngesini netleştirmeyi mümkün kıldı.
Büyük miktarda sodyum içeren kaynaklar şunlardır: rafine deniz tuzu, kaliteli soya sosları, çeşitli salamuralar, lahana turşusu, et suları. Onbirinci element deniz yosunu, istiridye, yengeç, taze havuç ve pancar, hindiba, kereviz ve karahindibada az miktarda bulunur.
Hikaye
Doğal sodyum bileşikleri - sofra tuzu NaCl ve soda Na2CO3 - eski çağlardan beri insanoğlu tarafından bilinmektedir. Eski Mısırlılar, soda göllerinin sularından elde edilen doğal sodayı mumyalama, tuvali ağartma, yemek pişirme, boya ve cila yapımında kullandılar. Mısırlılar bu bileşiğe neter adını verdiler, ancak bu terim yalnızca doğal soda için değil aynı zamanda bitki külünden elde edilenler de dahil olmak üzere genel olarak alkali için de geçerliydi. Daha sonra Yunan (Aristoteles, Dioscorides) ve Roma (Plutarkhos) kaynaklarında da bu maddeden bahsedilir, ancak zaten “nitron” adı altında. Antik Roma tarihçisi Yaşlı Pliny, Nil Deltası'nda sodanın (kendisi buna "nitrum" diyor) nehir suyundan izole edildiğini ve büyük parçalar halinde satıldığını yazmıştır. Başta kömür olmak üzere çok miktarda yabancı madde içeren bu tür soda, gri ve hatta bazen siyah bir renge sahipti. "Natron" terimi, 17. ve 18. yüzyıllarda yavaş yavaş kullanıldığı Arap ortaçağ edebiyatında ortaya çıkıyor. “natra” terimi, yani sofra tuzunun elde edilebileceği baz oluşur. Elementin modern adı “natra”dan gelir.
Modern kısaltma "Na" ve Latince "natrium" kelimesi ilk kez 1811'de akademisyen ve İsveç Hekimler Derneği'nin kurucusu Jens Jakob Berzelius tarafından soda da dahil olmak üzere doğal mineral tuzlarını belirtmek için kullanıldı. Bu yeni terim, metalik sodyumu ilk elde eden İngiliz kimyager Humphry Davy tarafından metale verilen orijinal "sodyum" adının yerini aldı. Davy'nin sodanın Latince adı olan “soda” tarafından yönlendirildiğine inanılıyor, ancak başka bir varsayım daha var: Arapça'da baş ağrısı anlamına gelen “suda” kelimesi var; eski zamanlarda bu rahatsızlık soda ile tedavi ediliyordu. Bazı Batı Avrupa ülkelerinde (İngiltere, Fransa, İtalya) ve Amerika Birleşik Devletleri'nde sodyumun sodyum olarak adlandırıldığını belirtmekte fayda var.
Sodyum bileşiklerinin çok uzun zamandır bilinmesine rağmen metali saf halde elde etmek ancak 1807 yılında İngiliz kimyager Humphry Davy tarafından hafif nemlendirilmiş katı sodyum hidroksit NaOH'ın elektrolizi ile mümkün oldu. Gerçek şu ki, metalin yüksek aktivitesi nedeniyle geleneksel kimyasal yöntemler kullanılarak sodyum elde edilemiyordu, ancak Davy'nin yöntemi o zamanın bilimsel düşüncesinin ve teknik gelişmelerinin ilerisindeydi. 19. yüzyılın başında gerçekten uygulanabilir ve uygun tek akım kaynağı bir volta sütunuydu. Davy'nin kullandığında 250 çift bakır ve çinko levha vardı. D.I. tarafından açıklanan süreç. Mendeleev'in çalışmalarından birinde son derece karmaşık ve enerji yoğundu: "Bir parça ıslak (bakır veya kömürden) kostik sodayı pozitif (bakır veya kömürden) kutba bağlayarak ve içinde bir oyuk açarak, içine cıva döküldü, güçlü bir voltaik sütunun negatif kutbuna ( katot) bağlandı, Davy, cıvada, bir akım geçtiğinde, cıvadan daha az uçucu olan ve suyu ayrıştırabilen ve yine kostik oluşturabilen özel bir metalin çözündüğünü fark etti. soda. Yüksek enerji yoğunluğu nedeniyle, alkalin yöntemi ancak 19. yüzyılın sonunda - daha gelişmiş enerji kaynaklarının ortaya çıkmasıyla - sanayileşmeye başladı ve 1924'te Amerikalı mühendis G. Downs, sodyumun elektrolitik üretim sürecini temelden değiştirdi. alkalinin çok daha ucuz sofra tuzu ile değiştirilmesi.
Davy'nin keşfinden bir yıl sonra, Joseph Gay-Lussac ve Louis Thénard sodyumu elektroliz yoluyla değil, kostik sodayı kırmızı ısıya kadar ısıtılan demirle reaksiyona sokarak elde ettiler. Daha sonra Sainte-Clair Deville, kireçtaşı varlığında sodanın kömürle indirgenmesiyle sodyumun elde edildiği bir yöntem geliştirdi.
Doğada olmak
Sodyum en yaygın elementlerden biridir - doğadaki niceliksel içerik açısından altıncı (metal olmayanlardan yalnızca oksijen daha yaygındır -% 49,5 ve silikon -% 25,3) ve metaller arasında dördüncü (yalnızca demir daha yaygındır -% 5,08, alüminyum - %7,5 ve kalsiyum - %3,39. Çeşitli tahminlere göre Clarke (yer kabuğundaki ortalama içerik) kütlece %2,27 ila %2,64 arasında değişmektedir. Bu elementin çoğu çeşitli alüminosilikatlarda bulunur. Sodyum, yer kabuğunun üst kısmının tipik bir elementidir; bu, çeşitli kayalardaki metal içeriğinin derecesine göre kolaylıkla görülebilir. Bu nedenle, en yüksek sodyum konsantrasyonu - ağırlıkça %2,77 - asidik magmatik kayaçlarda (granitler ve diğerleri) bulunur; bazik kayalarda (bazaltlar ve benzerleri), on birinci elementin ortalama içeriği zaten ağırlıkça %1,94'tür. . Ultramafik manto kayaçları yalnızca %0,57 ile en düşük sodyum içeriğine sahiptir. Tortul kayaçlar (killer ve şeyller) de on birinci element açısından fakirdir - ağırlıkça %0,66; toprakların çoğu sodyum açısından zengin değildir - ortalama içerik yaklaşık %0,63'tür.
Yüksek kimyasal aktivitesi nedeniyle sodyum doğada yalnızca tuz formunda bulunur. Bilinen sodyum minerallerinin toplam sayısı iki yüzün üzerindedir. Ancak bu alkali metal ve bileşiklerinin üretimi için ana kaynaklar olan bunların hepsi en önemlileri olarak kabul edilmez. Halit (kaya tuzu) NaCl, mirabilit (Glauber tuzu) Na2SO4 10H2O, Şili güherçilesi NaNO3, kriyolit Na3, tinkal (boraks) Na2B4O7∙10H2O, trona NaHCO3∙Na2CO3∙2H2O, tenardit Na2SO4'ün yanı sıra doğal silikatlardan bahsetmeye değer. albit Na, nefelin Na gibi, sodyuma ek olarak başka elementler de içerir. İyonik yarıçaplarının yakınlığından dolayı Na+ ve Ca2+ izomorfizmi sonucunda magmatik kayaçlarda sodyum-kalsiyum feldispatlar (plajiyoklazlar) oluşur.
Sodyum, deniz suyundaki ana metal elementtir; Dünya Okyanusu sularının 1,5 1016 ton sodyum tuzu içerdiği tahmin edilmektedir (Dünya Okyanusu sularındaki ortalama çözünebilir tuz konsantrasyonu yaklaşık 35 ppm'dir, bu da %3,5'tir). ağırlıkça sodyumun payı %1,07'dir. Bu kadar yüksek bir konsantrasyon, doğadaki sodyum döngüsünden kaynaklanmaktadır. Gerçek şu ki, bu alkali metal kıtalarda oldukça zayıf bir şekilde tutuluyor ve nehir suları aracılığıyla aktif olarak denizlere ve okyanuslara taşınıyor. Buharlaşma sırasında, sodyum tuzları kıyıdaki deniz lagünlerinde, ayrıca bozkır ve çöllerdeki kıtasal göllerde birikerek tuz içeren kaya katmanları oluşturur. Eski denizlerin buharlaşmasının bir sonucu olarak, tüm kıtalarda benzer sodyum tuzları birikintileri nispeten saf biçimde mevcuttur. Bu süreçler günümüzde de gerçekleşmeye devam etmektedir; örnekler arasında Utah'ta (ABD), Baskunchak'ta (Rusya, Akhtubinsky bölgesi), Altay Bölgesi'ndeki (Rusya) tuz gölleri, Ölü Deniz ve diğer benzer yerlerde bulunan Tuz Gölü sayılabilir.
Kaya tuzu, %90'dan fazla NaCl içeren geniş yer altı birikintileri (genellikle yüzlerce metre kalınlığında) oluşturur. Tipik bir Cheshire tuzu yatağı (İngiltere'deki sodyum klorürün ana kaynağı) 60 x 24 km'lik bir alanı kaplar ve yaklaşık 400 m kalınlığında bir tuz yatağına sahiptir. Tek başına bu yatağın değerinin 1011 tondan fazla olduğu tahmin edilmektedir.
Ek olarak, sodyum önemli bir biyoelementtir; canlı organizmalarda nispeten büyük miktarlarda bulunur (ortalama %0,02, çoğunlukla NaCl formunda) ve hayvanlarda bitkilere göre daha fazla bulunur. Sodyumun varlığı güneş atmosferinde ve yıldızlararası uzayda tespit edilmiştir. Atmosferin üst katmanlarında (yaklaşık 80 kilometre yükseklikte) bir atomik sodyum tabakası keşfedildi. Gerçek şu ki, böyle bir yükseklikte, sodyumun etkileşime girebileceği neredeyse hiç oksijen, su buharı ve diğer maddeler yoktur.
Başvuru
Sodyum metali ve bileşikleri çeşitli endüstrilerde yaygın olarak kullanılmaktadır. Yüksek reaktivitesi nedeniyle bu alkali metal, metalurjide niyobyum, titanyum, hafniyum ve zirkonyum gibi metallerin metalotermi yoluyla üretiminde indirgeyici madde olarak kullanılır. 19. yüzyılın ilk yarısında, alüminyumu (alüminyum klorürden) izole etmek için sodyum kullanılıyordu; bugün, onbirinci element ve tuzları hala bazı dökme alüminyum alaşımlarının üretiminde değiştirici olarak kullanılıyor. Sodyum aynı zamanda demiryolu vagonları için aks yataklarının imalatında kullanılan kurşun bazlı bir alaşımda (%0,58 Na) da kullanılır; bu alaşımdaki alkali metal bir takviye elemanıdır. Sodyum ve potasyumlu alaşımları nükleer reaktörlerdeki sıvı soğutuculardır - sonuçta her iki element de küçük termal nötron emme kesitlerine sahiptir (Na 0,49 ahır için). Ayrıca bu alaşımlar, yüksek kaynama noktaları ve ısı transfer katsayıları ile karakterize edilir ve nükleer güç reaktörlerinde geliştirilen yüksek sıcaklıklarda yapısal malzemelerle etkileşime girmez, dolayısıyla zincirleme reaksiyonun seyrini etkilemez.
Bununla birlikte, ısı transfer maddesi olarak sodyum kullanan yalnızca nükleer enerji değildir - 11 numaralı element, uçak motor valflerinde, kamyonlarda, 450 ila 650 ° C sıcaklık aralığında eşit ısıtma gerektiren işlemler için soğutucu olarak yaygın şekilde kullanılır. egzoz valfleri, enjeksiyonlu kalıplama makinelerinde basınç. Sodyum, potasyum ve sezyum alaşımı (%12 Na, %47 K, %41 Cs) rekor derecede düşük bir erime noktasına sahiptir (sadece 78 °C), bu nedenle iyon roket motorları için çalışma sıvısı olarak önerilmiştir. Kimya endüstrisinde sodyum, siyanür tuzları, sentetik deterjanlar (deterjenitler) ve farmasötik ürünlerin üretiminde kullanılır. Yapay kauçuk üretiminde sodyum, bütadien moleküllerini, özellikleri bakımından en iyi doğal kauçuk çeşitlerine göre daha düşük olmayan bir üründe birleştiren bir katalizör rolü oynar. NaPb bileşiği (ağırlıkça %10 Na), en etkili vuruntu önleyici madde olan tetraetil kurşunun üretiminde kullanılır. Sodyum buharı, yüksek ve düşük basınçlı gaz deşarjlı lambaları (NLLD ve NLND) doldurmak için kullanılır. Bir sodyum lambası neonla doldurulur ve az miktarda sodyum metali içerir; böyle bir lamba açıldığında neonda boşalma başlar. Deşarj sırasında açığa çıkan ısı, sodyumu buharlaştırır ve bir süre sonra neonun kırmızı parıltısının yerini sodyumun sarı parıltısı alır. Sodyum lambalar yüksek verimliliğe sahip güçlü ışık kaynaklarıdır (%70'e kadar laboratuvar koşullarında). Sodyum lambaların yüksek verimliliği, bunların otoyolları, tren istasyonlarını, marinaları ve diğer büyük ölçekli nesneleri aydınlatmak için kullanılmasını mümkün kılmıştır. Bu nedenle parlak sarı ışık üreten DNaT tipi (Arc Sodium Tubular) NLVD lambalar sokak aydınlatmasında çok yaygın olarak kullanılmaktadır, bu tür lambaların kullanım ömrü 12-24 bin saattir. Ayrıca DNaS, DNaMT (Ark Sodyum Mat), DNaZ (Ark Sodyum Ayna) ve DNaTBR (Cıvasız Ark Sodyum Borulu) lambalar bulunmaktadır. Sodyum, yüksek enerji yoğunluğuna sahip sodyum-sülfür pillerin üretiminde kullanılır. Organik sentezde sodyum indirgeme, yoğunlaşma, polimerizasyon ve diğer reaksiyonlarda kullanılır. Bazen, çok yüksek akımları taşıması amaçlanan elektrik kabloları için malzeme olarak sodyum metali kullanılır.
Çok sayıda sodyum bileşiği daha az yaygın değildir: gıda endüstrisinde sofra tuzu NaCl kullanılır; Sodyum hidroksit NaOH (kostik soda), sabun endüstrisinde, boya üretiminde, kağıt hamuru ve kağıt ve petrol endüstrilerinde, suni elyaf üretiminde ve ayrıca elektrolit olarak kullanılır. Soda - sodyum karbonat Na2CO3 cam, kağıt hamuru ve kağıt, gıda, tekstil, petrol ve diğer endüstrilerde kullanılır. Tarımda, Şili nitratı olarak bilinen nitrik asit NaNO3'ün sodyum tuzu gübre olarak yaygın şekilde kullanılmaktadır. Sodyum klorat NaClO3 demiryolu raylarındaki istenmeyen bitki örtüsünü yok etmek için kullanılır. Sodyum fosfat Na3PO4, cam ve boya üretiminde, gıda endüstrisinde ve fotoğrafçılıkta kullanılan deterjanların bir bileşenidir. Sodyum azit NaN3, metalurjide ve kurşun azit üretiminde nitrürleme maddesi olarak kullanılır. Sodyum siyanür NaCN, hidrometalurjik yöntemle altının kayalardan ayrıştırılmasında, ayrıca çeliğin nitrokarbürizasyonunda ve elektrokaplamada (gümüşleme, yaldızlama) kullanılır. Silikatlar mNa2O nSiO2, alüminosilikat katalizörlerin, ısıya dayanıklı, aside dayanıklı betonun üretimi için cam üretiminde yükün bileşenleridir.
Üretme
Bilindiği gibi metalik sodyum ilk kez 1807 yılında İngiliz kimyager Davy tarafından sodyum hidroksit NaOH'nin elektrolizi ile elde edildi. Bilimsel açıdan bakıldığında alkali metallerin izolasyonu kimya alanında büyük bir keşiftir. Bununla birlikte, o yılların endüstrisi bu olayın önemini takdir edemedi - birincisi, 19. yüzyılın başında endüstriyel ölçekte sodyum üretimi için gerekli kapasiteler henüz mevcut değildi ve ikincisi, kimse nerede olduğunu bilmiyordu. etkileşime girdiğinde alev alan yumuşak bir metal su ile faydalı olabilir. Ve eğer ilk zorluk 1808'de Joseph Gay-Lussac ve Louis Thénard tarafından, enerji yoğun elektrolize başvurmadan, kostik sodanın kırmızı ısıya ısıtılan demir ile reaksiyonunu kullanarak sodyum elde etme tarafından çözüldüyse, o zaman ikinci problem - alanı uygulama - yalnızca 1824 yılında alüminyumun sodyum yardımıyla izole edildiği yıl çözüldü. 19. yüzyılın ikinci yarısında Sainte-Clair Deville, kireçtaşı varlığında sodayı kömürle indirgeyerek metalik sodyum elde etmek için yeni bir yöntem geliştirdi:
Na2CO3 + 2C → 2Na + 3CO
Bu yöntem 1886'da geliştirildi. Bununla birlikte, 1890'da sodyum üretimine yönelik elektrolitik yöntem endüstriye tanıtıldı. Böylece Humphry Davy'nin fikri endüstriyel ölçekte ancak 80 yıl sonra hayata geçirildi! Tüm aramalar ve araştırmalar orijinal yönteme dönüşle sona erdi. 1924 yılında Amerikalı mühendis Downs, alkaliyi çok daha ucuz sofra tuzuyla değiştirerek elektrolitik olarak sodyum üretme işlemini daha ucuz hale getirdi. Bu modernizasyon, 6 bin tondan (1913) 180 bin tona (1966) çıkan sodyum metal üretimini etkiledi. Downes'in yöntemi, metalik sodyum elde etmek için kullanılan modern yöntemin temelini oluşturdu.
Şimdi sodyum metali üretmenin ana endüstriyel yöntemi, tuzun erime noktasını 575-585 ° 'ye düşüren KCl, NaF veya CaCl2 ilavesiyle erimiş sodyum klorürün (işlemin bir yan ürünü klordur) elektrolizidir. C. Aksi takdirde, saf sodyum klorürün elektrolizi, NaCl'nin erime noktaları (801 °C) ile sodyum metalinin kaynama noktaları (882,9 °C) çok yakın olduğundan, buharlaşma nedeniyle büyük metal kayıplarına yol açacaktır. İşlem diyaframlı çelik bir elektrolizörde gerçekleşir. Sodyum üretmek için kullanılan modern bir elektrolizör, bir fırını andıran etkileyici bir yapıdır. Ünite, dıştan çelik bir mahfaza ile çevrelenmiş refrakter tuğladan yapılmıştır. Elektrolizörün alt kısmından, halka şeklinde bir ağ ile çevrelenmiş bir grafit anot yerleştirilir - sodyumun, klorun biriktiği anot boşluğuna girmesini önleyen bir diyafram. Aksi halde sodyum, klorun içinde yanacaktır.
Halka şeklindeki katot demir veya bakırdan yapılmıştır. Sodyum ve klorun uzaklaştırılması için katot ve anotun üzerine kapaklar takılır. İyice kurutulmuş sodyum klorür ve kalsiyum klorürden oluşan bir karışım elektrolizöre yüklenir; böyle bir karışımın saf sodyum klorürden daha düşük bir sıcaklıkta eridiğini zaten biliyoruz. Tipik olarak işlem yaklaşık 600°C sıcaklıkta gerçekleşir. Elektrotlara yaklaşık 6 V'luk bir doğru akım sağlanırken, katotta Na+ iyonları boşaltılır ve metalik sodyum açığa çıkar, bu da yüzer ve özel bir koleksiyona alınır. Doğal olarak işlem hava erişimi olmadan gerçekleşir. Anotta, klor iyonları Сl– boşaltılır ve sodyum üretiminin değerli bir yan ürünü olan klor gazı açığa çıkar. Elektrolizörün çalıştığı gün boyunca 400-500 kg sodyum ve 600-700 kg klor üretilir. Bu şekilde elde edilen metal, erimiş sodyuma bir NaOH + Na2C03 + NaCl veya Na202 karışımı eklenerek safsızlıklardan (klorürler, oksitler ve diğerleri) arıtılır; eriyiğin metalik lityum, titanyum veya titanyum-zirkonyum alaşımı, düşük klorürler TiCl3, TiCl2 ile işlenmesi; Vakumla damıtma.
Fiziki ozellikleri
Humphry Davy yalnızca metalik sodyumu elde eden ilk kişi değil, aynı zamanda onun özelliklerini inceleyen ilk kişiydi. Londra'da yeni elementlerin (potasyum ve sodyum) keşfi hakkında haber yapan kimyager, ilk kez yeni metallerin örneklerini bilimsel bir izleyici kitlesine gösterdi. İngiliz kimyager, sodyumun etkileşime girmediği ve çevresinde oksitlenmediği bir gazyağı tabakası altında bir parça metalik sodyum depolayarak parlak gümüş rengini korudu. Ayrıca sodyum (20 °C'de yoğunluğu 0,968 g/cm3'tür) kerosenden daha ağırdır (değişen saflaştırma derecelerinde 20 °C'de yoğunluğu 0,78-0,85 g/cm3'tür) ve yüzeyinde yüzmez, bu nedenle oksijen ve karbondioksit ile oksidasyona uğramaz. Davy, kendisini yeni bir metal numunesinin bulunduğu bir kabın olağan gösterimi ile sınırlamadı; kerosenden sodyumu aldı ve numuneyi bir kova suya attı. Herkesi şaşırtacak şekilde, metal batmadı, ancak suyun yüzeyinde aktif olarak hareket etmeye başladı, bazıları tutuşan küçük parlak damlacıklar halinde eridi. Gerçek şu ki, suyun yoğunluğu (20 °C'de 0,998 g/cm3'tür) bu alkali metalin yoğunluğundan daha yüksektir, bu nedenle sodyum suda batmaz, ancak içinde yüzerek onunla aktif olarak etkileşime girer. Halk, yeni bir unsurun böyle bir "sunumuna" hayran kaldı.
Sodyumun fiziksel özellikleri hakkında şimdi ne söyleyebiliriz? Periyodik tablonun onbirinci elementi yumuşak (bıçakla kolayca kesilebilen, preslenmeye ve yuvarlanmaya uygun), hafif, parlak gümüşi beyaz bir metaldir ve havada hızla kararır. İnce sodyum katmanları mor bir renk tonuna sahiptir ve basınç altında metal yakut gibi şeffaf ve kırmızı hale gelir. Sıradan sıcaklıklarda sodyum, aşağıdaki parametrelerle kübik bir kafes içinde kristalleşir: a = 4,28 A, atom yarıçapı 1,86 A, iyon yarıçapı Na+ 0,92 A. Sodyum atomunun iyonizasyon potansiyeli (eV) 5,138; 47.20; 71.8; metalin elektronegatifliği 0,9'dur. Elektron çalışma fonksiyonu 2,35 eV. Bu modifikasyon -222 °C'nin üzerindeki sıcaklıklarda stabildir. Bu sıcaklığın altında altıgen modifikasyon aşağıdaki parametrelerle stabildir: a = 0,3767 nm, c = 0,6154 nm, z = 2.
Sodyum eriyebilir bir metaldir, erime noktası yalnızca 97,86 °C'dir. Bu metalin aktif olarak etkileşime girmemesi halinde kaynar suda eriyebileceği ortaya çıktı. Ayrıca erime sırasında sodyumun yoğunluğu %2,5 azalırken hacmi ΔV = 27,82∙10-6 m3/kg artar. Basınç arttıkça metalin erime noktası artarak 3 GPa'da 242°C'ye ve 8 GPa'da 335°C'ye ulaşır. Erimiş sodyumun kaynama noktası 883,15° C'dir. Normal basınçta sodyumun buharlaşma ısısı = 3869 kJ/kg. Onbirinci elementin (oda sıcaklığında) özgül ısı kapasitesi 1,23±103 J/(kg K) veya 0,295 cal/(g derece); sodyumun termal iletkenlik katsayısı 1,32 ± 102 W/(m·K) veya 0,317 cal/(cm sec derece)'dir. Bu alkali metalin (20 °C sıcaklıkta) doğrusal genleşmenin termal katsayısı 7,1 ± 10-5'tir. Sodyumun elektriksel direnci (0 °C'de) 4,3 x 10-8 ohm·m (4,3 x 10-6 ohm cm)'dir. Eritildiğinde sodyumun elektriksel direnci 1.451 kat artar. Sodyum paramanyetiktir, spesifik manyetik duyarlılığı +9,2 10-6'dır. Sodyum HB'nin Brinell sertliği = 0,7 MPa. Oda sıcaklığında normal çekme modülü E = 5,3 GPa. Sodyumun sıkıştırılabilirliği x = 15,99∙10-11 Pa-1. Sodyum çok esnek bir metaldir ve soğukta kolayca deforme olur. N. S. Kurnakov ve S. F. Zhemchuzhny'ye göre sodyum çıkış basıncı, çıkışın çapına bağlı olarak 2,74-3,72 MPa aralığındadır.
Kimyasal özellikler
Hidritler de dahil olmak üzere kimyasal bileşiklerde sodyum, +1 oksidasyon durumu sergiler. Onbirinci element en reaktif metallerden biridir, bu nedenle doğada saf haliyle bulunmaz. Oda sıcaklığında bile atmosferik oksijen, su buharı ve karbondioksit ile aktif olarak reaksiyona girerek yüzeyde peroksit, hidroksit ve karbonat karışımından oluşan gevşek bir kabuk oluşturur. Bu nedenle sodyum metali, susuzlaştırılmış bir sıvı (gazyağı, mineral yağ) tabakası altında depolanır. Soy gazlar katı ve sıvı sodyumda hafifçe çözünür; 200 °C'de sodyum hidrojeni absorbe etmeye başlar ve çok higroskopik bir hidrit NaH oluşturur. Bu alkali metal, akkor deşarjda nitrojenle son derece zayıf bir şekilde reaksiyona girerek çok kararsız bir madde olan sodyum nitrür oluşturur:
6Na + N2 → 2Na3N
Sodyum nitrür kuru havada stabildir ancak su veya alkolle anında ayrışarak amonyak oluşturur.
Sodyum oksijenle doğrudan etkileşime girdiğinde şartlara bağlı olarak Na2O oksit (sodyumun yetersiz miktarda oksijende yakılması durumunda) veya Na2O2 peroksit (sodyumun havada veya fazla oksijende yakılmasıyla) oluşur. Sodyum oksit belirgin temel özellikler sergiler; güçlü bir baz olan NaOH hidroksit oluşturmak üzere suyla şiddetli reaksiyona girer:
Na2O + H2O → 2NaOH
Sodyum hidroksit, katı beyaz higroskopik kristaller formunda, suda oldukça çözünür bir alkalidir (108 g NaOH, 20 °C'de 100 g suda çözünür), cildi, kumaşları, kağıdı ve diğer organik maddeleri aşındırır. Suda çözündüğünde büyük miktarda ısı açığa çıkar. Havada, sodyum hidroksit aktif olarak karbondioksiti emer ve sodyum karbonata dönüşür:
2NaOH + CO2 → Na2CO3 + H2O
Bu nedenle sodyum hidroksitin hava geçirmez kaplarda saklanması gerekir. Endüstride NaOH, iyon değişim membranları ve diyaframları kullanılarak NaCl veya Na2CO3'ün sulu çözeltilerinin elektrolizi ile elde edilir:
2NaCl + 2H2O → 2NaOH + Cl2 + H2
Sodyum peroksit, ayrışmadan eriyen soluk sarı bir tozdur, Na2O2 çok güçlü bir oksitleyici maddedir. Çoğu organik madde onunla temas ettiğinde tutuşur. Na2O2 karbondioksitle reaksiyona girdiğinde oksijen açığa çıkar:
2Na2O2 + 2CO2 → 2Na2CO3 + O2
Metalik sodyum, oksitleri gibi, hidroksit NaOH oluşturmak ve hidrojeni serbest bırakmak için su ile aktif olarak etkileşime girer; geniş bir temas yüzeyi ile reaksiyon patlayıcı bir şekilde ilerler. Sodyum alkollerle sudan çok daha sakin bir şekilde reaksiyona girerek sodyum alkoksit ortaya çıkar. Böylece, etanol ile reaksiyona giren sodyum, sodyum etanolat C2H5ONa'yı verir:
2Na + 2C2H5OH → 2C2H5ONa + H2
Sodyum hemen hemen tüm asitlerde çözünerek çok sayıda tuz oluşturur:
2Nа + 2НCl → 2NаСl + Н2
2Na + 2H2SO4 → SO2 + Na2SO4 + 2H2O
Flor ve klor atmosferinde sodyum kendiliğinden tutuşur, ısıtıldığında brom ile reaksiyona girer ve iyot ile doğrudan etkileşime girmez. Bir havanda öğütüldüğünde kükürt ile şiddetli reaksiyona girerek değişken bileşimde sülfürler oluşturur. Sodyum sülfür Na2S, sodyum sülfatın karbonla indirgenmesiyle elde edilir. Sodyumun kükürt ve oksijenle çok yaygın bir bileşiği Glauber tuzu Na2SO4∙10H2O olarak adlandırılır. Sülfürün yanı sıra selenyum ve tellür ile aktif olarak reaksiyona girerek Na2X, NaX, NaX2, Na2X5 bileşimlerinin kalkojenitlerini oluşturur.
Sodyum, amonyak kompleksleri (metalik iletkenliğe sahip mavi bir çözelti) oluşturmak üzere sıvı amonyakta (0 °C'de 100 g NH3 başına 34,6 g) çözünür. Amonyak buharlaştığında, orijinal metal kalır; çözeltinin uzun süreli depolanması sırasında, metalin amonyakla reaksiyona girerek amid NaNH2 veya imid Na2NH oluşturması ve hidrojen salınması nedeniyle yavaş yavaş rengi değişir. Gaz halindeki amonyak, 300-350 °C'de erimiş sodyumdan geçirildiğinde, su tarafından kolaylıkla ayrışabilen renksiz kristal bir madde olan sodyum amin NaNH2 oluşur.
800-900 °C'de karbonlu sodyum gazı karbür (asetilenit) Na2C2'yi oluşturur. Sodyum grafit ile inklüzyon bileşikleri oluşturur.
Sodyum, gümüş, altın, kalay, kurşun, bizmut, sezyum, potasyum ve diğer metallerle birlikte bir dizi metallerarası bileşik oluşturur. Baryum, stronsiyum, magnezyum, lityum, çinko ve alüminyum ile bileşik oluşturmaz. Sodyum, cıva ile birlikte amalgamlar oluşturur - NaHg2, NaHg4, NaHg8, NaHg, Na3Hg2, Na5Hg2, Na3Hg bileşiminin intermetalik bileşikleri. Önemli olan, bir kerosen veya mineral yağ tabakası altında bulunan cıvaya yavaş yavaş sodyumun eklenmesiyle elde edilen sıvı amalgamlardır (ağırlıkça %2,5'ten az sodyum içerir).
Kimyasal özellikleri organolityum bileşiklerine benzer, ancak reaktivite açısından onlardan üstün olan çok sayıda organosodyum bileşiği bilinmektedir.
Sodyum, D.I. Mendeleev tarafından kimyasal elementlerin periyodik tablosunun üçüncü periyodunun ilk grubunda yer alan basit bir maddedir. İnce tabakalara bölündüğünde menekşe rengine sahip, çok yumuşak, gümüşi bir alkali metaldir. Sodyumun erime noktası suyun kaynaması için gerekli olanın hemen altındadır ve kaynama noktası 883 santigrat derecedir. Oda sıcaklığında yoğunluğu 0,968 g/cm3'tür. Düşük yoğunluğu nedeniyle gerektiğinde normal bir bıçakla sodyum kesilebilir.
Sodyum gezegenimizde çok yaygındır: çeşitli bileşikleri burada hem denizde hem de göreceli olarak büyük miktarlarda bulunan yer kabuğunda ve birçok canlı organizmada bulunabilir, ancak canlı doğada saf haliyle bulunmaz. inanılmaz yüksek aktivitesi nedeniyle. Sodyum, normal insan yaşamı için gerekli olan temel mikro elementlerden biridir - bu nedenle vücuttan doğal kaybını yenilemek için yaklaşık 4-5 gram bileşiğinin klor ile tüketilmesi gerekir - yani. normal sofra tuzu.
Tarihte sodyum
Eski Mısır'dan beri insanoğlunun çeşitli sodyum bileşikleri bilinmektedir. Mısırlılar, çeşitli günlük ihtiyaçlar için tuzlu Natron Gölü'nden sodyum içeren sodayı aktif olarak kullanan ilk kişilerdi. İncil'de sodyum bileşiklerinden deterjanın bir bileşeni olarak bahsedilmişti, ancak sodyum ilk kez saf haliyle 1807'de İngiliz kimyager Humphrey Davy tarafından türevleriyle yapılan deneyler sırasında elde edildi.
Sodyum başlangıçta Arapça baş ağrısı anlamına gelen kelimeden türetilen sodyum olarak adlandırıldı. "Sodyum" kelimesi Mısır dilinden alınmıştır ve modern tarihte ilk kez İsveç Hekimler Derneği tarafından soda içeren mineral tuzları tanımlamak için kullanılmıştır.
Sodyumun kimyasal özellikleri
Sodyum aktif bir alkali metaldir; Havayla temas ettiğinde çok çabuk oksitlenir ve gazyağı içinde saklanması gerekir; sodyum ise çok düşük bir yoğunluğa sahiptir ve genellikle yüzeyinde yüzer. Çok güçlü bir indirgeyici madde olan sodyum, çoğu metal olmayan maddeyle reaksiyona girer ve aktif bir metal olduğundan, kullanımıyla reaksiyonlar genellikle çok hızlı ve şiddetli gerçekleşir. Örneğin, suya bir parça sodyum koyarsanız, aktif olarak tutuşmaya başlar ve bu da sonuçta bir patlamaya yol açar. Sodyum ve türevleri diğer birçok maddeyle reaksiyona girdiğinde tutuşma ve oksijen salınımı meydana gelir, ancak seyreltik asitlerle sıradan bir metal gibi reaksiyona girer. Sodyum soy gazlar, iyot ve karbonla reaksiyona girmez ve ayrıca nitrojenle çok zayıf reaksiyona girerek koyu gri kristaller - sodyum nitrür formunda oldukça kararsız bir madde oluşturur.
Sodyum uygulamaları
Sodyum esas olarak kimya endüstrisinde ve metalurjide kullanılır; burada kimyasal özellikleri nedeniyle çoğunlukla indirgeyici bir madde olarak kullanılır. Aynı zamanda eter ve benzeri gibi organik çözücüler için kurutucu olarak da kullanılır; Muazzam gerilimlere dayanabilen tellerin üretimi için. Aynı bölgede özgül enerjisi yüksek olan sodyum-kükürt pillerin üretiminde ana bileşen olarak sodyum kullanılmaktadır. daha az yakıt tüketimi. Bu tür pillerin ana dezavantajı, yüksek çalışma sıcaklığı ve buna bağlı olarak bir kaza durumunda tutuşma ve sodyumun patlaması riskidir.
Sodyumun başka bir uygulama alanı, birçok sodyum türevinin, çeşitli karmaşık ilaçların yanı sıra antiseptiklerin oluşturulmasında reaktifler, ara maddeler ve yardımcı maddeler olarak kullanıldığı farmakolojidir. Bir sodyum klorür çözeltisi, insan kan plazmasına nispeten benzerdir ve vücuttan hızla atılır, bu nedenle kan basıncını korumak ve normalleştirmek gerektiğinde kullanılır.
Günümüzde bazı sodyum bileşikleri beton ve diğer yapı malzemelerinin üretiminde önemli bir bileşendir. Sodyum türevi bileşenler içeren malzemelerin kullanımı sayesinde düşük sıcaklıklarda inşaat işlerinde kullanılabilirler.
Sodyumun bolluğu ve endüstriyel üretiminin kolaylığı nedeniyle oldukça düşük bir maliyeti vardır. Bugün, ilk elde edildiği zamankiyle aynı şekilde, sodyum içeren çeşitli kayaların güçlü bir elektrik akımına maruz bırakılmasıyla üretiliyor. Bu sayede birçok sanayi dalındaki gerekliliğin yanı sıra üretim hacimleri de artıyor.