Chất quan trọng nhất của hành tinh chúng ta, độc đáo về tính chất và thành phần, tất nhiên là nước. Rốt cuộc, nhờ có cô ấy mà có sự sống trên Trái đất, trong khi không có sự sống trên các vật thể khác của hệ mặt trời được biết đến ngày nay. Rắn, lỏng, ở dạng hơi nước - bất kỳ thứ gì đều cần thiết và quan trọng. Nước và các tính chất của nó là đối tượng nghiên cứu của toàn bộ ngành khoa học - thủy văn.
Lượng nước trên hành tinh
Nếu chúng ta xem xét chỉ số về lượng oxit này ở tất cả các trạng thái kết tụ, thì nó chiếm khoảng 75% tổng khối lượng trên hành tinh. Trong trường hợp này, người ta phải tính đến nước liên kết trong các hợp chất hữu cơ, sinh vật sống, khoáng chất và các nguyên tố khác.
Nếu chỉ tính đến trạng thái lỏng và rắn của nước thì con số này giảm xuống còn 70,8%. Chúng ta hãy xem xét cách phân bổ các tỷ lệ phần trăm này, nơi chứa chất được đề cập.
- Có 360 triệu km 2 nước mặn ở các đại dương, biển và hồ nước mặn trên Trái đất.
- Nước ngọt phân bố không đồng đều: 16,3 triệu km2 trong số đó bị bao bọc trong băng ở các sông băng ở Greenland, Bắc Cực và Nam Cực.
- 5,3 triệu km2 hydro oxit tập trung ở các sông, đầm lầy và hồ nước ngọt.
- Lượng nước ngầm lên tới 100 triệu m3.
Đó là lý do tại sao các phi hành gia từ không gian xa xôi có thể nhìn thấy Trái đất có hình dạng một quả bóng màu xanh với những vùng đất hiếm gặp. Nước và các tính chất của nó, kiến thức về đặc điểm cấu trúc của nó là những yếu tố quan trọng của khoa học. Ngoài ra, gần đây nhân loại đã bắt đầu gặp phải tình trạng thiếu nước ngọt rõ rệt. Có lẽ kiến thức như vậy sẽ giúp giải quyết vấn đề này.
Thành phần của nước và cấu trúc phân tử
Nếu chúng ta xem xét các chỉ số này, các đặc tính mà chất tuyệt vời này thể hiện sẽ ngay lập tức trở nên rõ ràng. Do đó, một phân tử nước bao gồm hai nguyên tử hydro và một nguyên tử oxy nên nó có công thức thực nghiệm H 2 O. Ngoài ra, electron của cả hai nguyên tố đều đóng vai trò quan trọng trong cấu tạo của chính phân tử. Chúng ta hãy xem cấu trúc của nước và tính chất của nó là gì.

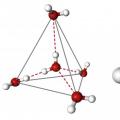
Rõ ràng là mỗi phân tử được định hướng xung quanh phân tử khác và chúng cùng nhau tạo thành một mạng tinh thể chung. Điều thú vị là oxit được chế tạo theo hình tứ diện - một nguyên tử oxy ở trung tâm và hai cặp electron và hai nguyên tử hydro xung quanh nó không đối xứng. Nếu bạn vẽ các đường đi qua tâm của các hạt nhân nguyên tử và nối chúng lại, bạn sẽ có được một hình học chính xác là tứ diện.
Góc giữa tâm nguyên tử oxy và hạt nhân hydro là 104,5 0 C. Độ dài liên kết O-H = 0,0957 nm. Sự hiện diện của các cặp electron của oxy, cũng như ái lực điện tử của nó lớn hơn so với hydro, đảm bảo sự hình thành trường tích điện âm trong phân tử. Ngược lại, hạt nhân hydro tạo thành phần tích điện dương của hợp chất. Như vậy, hóa ra phân tử nước là một lưỡng cực. Điều này quyết định nước có thể là gì và tính chất vật lý của nó cũng phụ thuộc vào cấu trúc của phân tử. Đối với chúng sinh, những đặc điểm này đóng một vai trò quan trọng.
Tính chất vật lý cơ bản
Chúng thường bao gồm mạng tinh thể, điểm sôi và điểm nóng chảy và các đặc tính riêng biệt. Chúng ta hãy xem xét tất cả chúng.
- Cấu trúc mạng tinh thể của hydro oxit phụ thuộc vào trạng thái kết tụ. Nó có thể ở dạng rắn - băng, lỏng - nước cơ bản trong điều kiện bình thường, khí - hơi nước khi nhiệt độ nước tăng lên trên 100 0 C. Nước đá tạo thành những tinh thể có hoa văn đẹp mắt. Toàn bộ mạng tinh thể lỏng lẻo, nhưng kết nối rất mạnh và mật độ thấp. Bạn có thể thấy nó trong ví dụ về những bông tuyết hoặc những họa tiết băng giá trên kính. Trong nước thông thường, mạng không có hình dạng cố định, nó thay đổi và chuyển từ trạng thái này sang trạng thái khác.
- Một phân tử nước ngoài không gian có dạng hình cầu đều đặn. Tuy nhiên, dưới tác dụng của lực hấp dẫn của trái đất, nó bị biến dạng và ở trạng thái lỏng có dạng một chiếc tàu.
- Thực tế là hydro oxit là một lưỡng cực trong cấu trúc xác định các tính chất sau: độ dẫn nhiệt và nhiệt dung cao, có thể thấy ở sự làm nóng nhanh và làm lạnh lâu của chất, khả năng định hướng cả các ion và từng electron và các hợp chất xung quanh chính nó . Điều này làm cho nước trở thành một dung môi phổ quát (cả cực và trung tính).
- Thành phần của nước và cấu trúc của phân tử giải thích khả năng hợp chất này hình thành nhiều liên kết hydro, bao gồm cả các hợp chất khác có cặp electron đơn độc (amoniac, rượu và các chất khác).
- Điểm sôi của nước lỏng là 100 0 C, sự kết tinh xảy ra ở +4 0 C. Dưới chỉ báo này có băng. Nếu bạn tăng áp suất thì nhiệt độ sôi của nước sẽ tăng mạnh. Vì vậy, ở khí quyển cao, chì có thể tan chảy trong đó, nhưng nó thậm chí sẽ không sôi (trên 300 0 C).
- Tính chất của nước rất có ý nghĩa đối với sinh vật. Ví dụ, một trong những điều quan trọng nhất là sức căng bề mặt. Đây là sự hình thành một lớp màng bảo vệ mỏng trên bề mặt oxit hydro. Chúng ta đang nói về nước lỏng. Rất khó để phá vỡ bộ phim này bằng hành động cơ học. Các nhà khoa học đã xác định rằng sẽ cần một lực tương đương với trọng lượng 100 tấn. Làm thế nào để phát hiện ra nó? Màng này hiện rõ khi nước chảy chậm từ vòi. Có thể thấy, nó giống như ở trong một loại vỏ nào đó, bị kéo căng đến một giới hạn và trọng lượng nhất định rồi rơi ra dưới dạng một giọt tròn, hơi bị biến dạng bởi trọng lực. Nhờ sức căng bề mặt nên nhiều vật có thể nổi trên mặt nước. Côn trùng có khả năng thích nghi đặc biệt có thể di chuyển tự do dọc theo nó.
- Nước và các tính chất của nó rất dị thường và độc đáo. Theo các chỉ số cảm quan, hợp chất này là một chất lỏng không màu, không có mùi vị. Cái mà chúng ta gọi là mùi vị của nước là các khoáng chất và các thành phần khác hòa tan trong đó.
- Độ dẫn điện của hydro oxit ở trạng thái lỏng phụ thuộc vào lượng muối hòa tan trong đó và lượng muối nào. Nước cất không chứa tạp chất nên không dẫn điện.
Nước đá là một trạng thái đặc biệt của nước. Trong cấu trúc ở trạng thái này, các phân tử được kết nối với nhau bằng liên kết hydro và tạo thành mạng tinh thể đẹp mắt. Nhưng nó khá không ổn định và có thể dễ dàng tách ra, tan chảy, tức là bị biến dạng. Có nhiều khoảng trống giữa các phân tử, kích thước của chúng vượt quá kích thước của chính các hạt. Do đó, mật độ của băng nhỏ hơn mật độ của hydro oxit lỏng.

Điều này có tầm quan trọng lớn đối với sông, hồ và các vùng nước ngọt khác. Thật vậy, vào mùa đông, nước trong đó không đóng băng hoàn toàn mà chỉ được bao phủ bởi một lớp băng dày đặc nhẹ hơn nổi lên trên. Nếu đặc tính này không phải là đặc điểm của trạng thái rắn của oxit hydro thì các hồ chứa sẽ đóng băng. Cuộc sống dưới nước sẽ là không thể.
Ngoài ra, trạng thái rắn của nước có tầm quan trọng lớn vì là nguồn cung cấp một lượng lớn nước uống sạch. Đây là những sông băng.
Một tính chất đặc biệt của nước có thể gọi là hiện tượng điểm ba. Đây là trạng thái mà băng, hơi nước và chất lỏng có thể tồn tại đồng thời. Điều này đòi hỏi các điều kiện sau:
- áp suất cao - 610 Pa;
- nhiệt độ 0,01 0 C.
Độ trong của nước thay đổi tùy theo tạp chất lạ. Chất lỏng có thể hoàn toàn trong suốt, trắng đục hoặc đục. Sóng màu vàng và đỏ bị hấp thụ, tia tím xuyên sâu.

Tính chất hóa học
Nước và các tính chất của nó là một công cụ quan trọng để hiểu được nhiều quá trình sống. Vì thế chúng đã được nghiên cứu rất kỹ. Vì vậy, thủy hóa quan tâm đến nước và các tính chất hóa học của nó. Trong số đó có những điều sau đây:
- Độ cứng. Đây là một tính chất được giải thích bởi sự có mặt của muối canxi và magie và các ion của chúng trong dung dịch. Nó được chia thành vĩnh viễn (muối của các kim loại được đặt tên: clorua, sunfat, sunfit, nitrat), tạm thời (bicarbonat), được loại bỏ bằng cách đun sôi. Ở Nga, nước được làm mềm bằng hóa chất trước khi sử dụng để có chất lượng tốt hơn.
- Khoáng hóa. Một tính chất dựa trên mômen lưỡng cực của hydro oxit. Nhờ sự hiện diện của nó, các phân tử có thể gắn vào mình nhiều chất, ion khác và giữ chúng. Đây là cách các cộng sự, clathrates và các hiệp hội khác được hình thành.
- Tính chất oxi hóa khử. Là một dung môi, chất xúc tác và chất kết hợp phổ quát, nước có khả năng tương tác với nhiều hợp chất đơn giản và phức tạp. Với một số nó hoạt động như một tác nhân oxy hóa, với một số khác - ngược lại. Là chất khử, nó phản ứng với halogen, muối, một số kim loại kém hoạt động hơn và với nhiều chất hữu cơ. Hóa học hữu cơ nghiên cứu những biến đổi mới nhất. Nước và các tính chất của nó, đặc biệt là các tính chất hóa học, cho thấy nó phổ biến và độc đáo như thế nào. Là một tác nhân oxy hóa, nó phản ứng với các kim loại hoạt động, một số muối nhị phân, nhiều hợp chất hữu cơ, cacbon và metan. Nói chung, các phản ứng hóa học liên quan đến một chất nhất định đòi hỏi phải lựa chọn những điều kiện nhất định. Kết quả của phản ứng sẽ phụ thuộc vào họ.
- Tính chất sinh hóa. Nước là một phần không thể thiếu trong mọi quá trình sinh hóa trong cơ thể, là dung môi, chất xúc tác và môi trường.
- Tương tác với khí để tạo thành clathrates. Nước lỏng thông thường có thể hấp thụ ngay cả các khí không hoạt động về mặt hóa học và đặt chúng vào các khoang giữa các phân tử của cấu trúc bên trong. Các hợp chất như vậy thường được gọi là clathrates.
- Với nhiều kim loại, hydro oxit tạo thành hydrat tinh thể, trong đó nó không thay đổi. Ví dụ, đồng sunfat (CuSO 4 * 5H 2 O), cũng như hydrat thông thường (NaOH * H 2 O và các loại khác).
- Nước được đặc trưng bởi các phản ứng hợp chất trong đó các loại chất mới (axit, kiềm, bazơ) được hình thành. Chúng không phải là oxi hóa khử.
- Điện phân. Dưới tác dụng của dòng điện, phân tử bị phân hủy thành các khí thành phần - hydro và oxy. Một trong những cách để có được chúng là trong phòng thí nghiệm và công nghiệp.
Theo quan điểm của lý thuyết Lewis, nước đồng thời là một axit yếu và một bazơ yếu (ampholyte). Nghĩa là, chúng ta có thể nói về tính chất lưỡng tính nhất định trong tính chất hóa học.

Nước và những đặc tính có lợi của nó đối với sinh vật
Thật khó để đánh giá quá cao tầm quan trọng của hydro oxit đối với mọi sinh vật. Suy cho cùng, nước chính là nguồn gốc của sự sống. Được biết, nếu không có nó, một người không thể sống dù chỉ một tuần. Nước, tính chất và ý nghĩa của nó đơn giản là rất lớn.
- Nó là một dung môi phổ quát, nghĩa là có khả năng hòa tan cả hợp chất hữu cơ và vô cơ, hoạt động trong hệ thống sống. Đó là lý do tại sao nước là nguồn và môi trường cho tất cả các quá trình biến đổi sinh hóa có xúc tác xảy ra, với sự hình thành các hợp chất phức tạp quan trọng.
- Khả năng hình thành liên kết hydro làm cho chất này có khả năng chịu được nhiệt độ cao mà không làm thay đổi trạng thái kết tụ của nó. Nếu không phải vậy, chỉ cần giảm độ một chút, nó sẽ biến thành băng bên trong sinh vật, gây chết tế bào.
- Đối với con người, nước là nguồn cung cấp mọi nhu cầu và nhu cầu cơ bản trong gia đình: nấu ăn, giặt giũ, dọn dẹp, tắm rửa, tắm rửa, bơi lội...
- Các nhà máy công nghiệp (hóa chất, dệt may, kỹ thuật, thực phẩm, lọc dầu và các ngành khác) sẽ không thể thực hiện công việc của mình nếu không có sự tham gia của hydro oxit.
- Từ xa xưa, người ta đã tin rằng nước là nguồn sức khỏe. Ngày nay nó đã và đang được sử dụng như một dược chất.
- Thực vật sử dụng nó làm nguồn dinh dưỡng chính, nhờ đó chúng tạo ra oxy, loại khí cho phép sự sống tồn tại trên hành tinh của chúng ta.
Chúng ta có thể kể tên hàng tá lý do nữa tại sao nước là chất phổ biến, quan trọng và cần thiết nhất cho mọi vật thể sống và được tạo ra nhân tạo. Chúng tôi chỉ trích dẫn những điều chính, rõ ràng nhất.

Chu trình thủy văn của nước
Nói cách khác, đây là chu kỳ của nó trong tự nhiên. Một quá trình rất quan trọng cho phép chúng ta liên tục bổ sung nguồn nước đang cạn kiệt. Nó xảy ra như thế nào?
Có ba thành phần chính: nước ngầm (hoặc nước ngầm), nước mặt và Đại dương Thế giới. Bầu không khí ngưng tụ và tạo ra lượng mưa cũng rất quan trọng. Những người tham gia tích cực vào quá trình này là thực vật (chủ yếu là cây), có khả năng hấp thụ lượng nước khổng lồ mỗi ngày.
Vì vậy, quá trình diễn ra như sau. Nước ngầm lấp đầy các mao mạch dưới lòng đất và chảy lên bề mặt và Đại dương Thế giới. Nước bề mặt sau đó được thực vật hấp thụ và thoát ra môi trường. Sự bốc hơi cũng xảy ra ở những khu vực rộng lớn như đại dương, biển, sông, hồ và các vùng nước khác. Khi ở trong khí quyển, nước làm gì? Nó ngưng tụ và chảy ngược lại dưới dạng mưa (mưa, tuyết, mưa đá).
Nếu những quá trình này không xảy ra thì nguồn cung cấp nước, đặc biệt là nước ngọt, đã cạn kiệt từ lâu. Đó là lý do tại sao người ta rất chú trọng đến việc bảo vệ và chu trình thủy văn bình thường.
Khái niệm nước nặng
Trong tự nhiên, hydro oxit tồn tại dưới dạng hỗn hợp các chất đồng vị. Điều này là do hydro tạo thành ba loại đồng vị: protium 1H, deuterium 2H, triti 3H. Ngược lại, oxy cũng không bị tụt lại phía sau và tạo thành ba dạng ổn định: 16 O, 17 O, 18 O Nhờ đó, không chỉ có nước protium thông thường có thành phần H 2 O (1 H và 16 O), mà còn có deuterium và tritium.

Đồng thời, deuterium (2 H) có cấu trúc và hình thức ổn định, có mặt trong thành phần của hầu hết các loại nước tự nhiên, nhưng với số lượng nhỏ. Đây là những gì họ gọi là nặng nề. Nó hơi khác so với bình thường hoặc nhẹ nhàng về mọi mặt.
Nước nặng và các tính chất của nó được đặc trưng bởi một số điểm.
- Kết tinh ở nhiệt độ 3,82 0 C.
- Điểm sôi được quan sát thấy ở 101,42 0 C.
- Mật độ là 1,1059 g/cm3.
- Là một dung môi, nó tệ hơn nhiều lần so với nước nhẹ.
- Nó có công thức hóa học D 2 O.
Khi tiến hành các thí nghiệm cho thấy ảnh hưởng của nước như vậy đến hệ thống sống, người ta thấy rằng chỉ một số loại vi khuẩn có khả năng sống trong đó. Phải mất thời gian để các thuộc địa thích nghi và thích nghi. Tuy nhiên, sau khi thích nghi, chúng đã khôi phục hoàn toàn mọi chức năng quan trọng (sinh sản, dinh dưỡng). Ngoài ra, thép có khả năng chống bức xạ rất cao. Các thí nghiệm trên ếch và cá không cho kết quả khả quan.
Các lĩnh vực ứng dụng hiện đại của deuterium và nước nặng được hình thành bởi nó là hạt nhân và năng lượng hạt nhân. Nước như vậy có thể thu được trong điều kiện phòng thí nghiệm bằng phương pháp điện phân thông thường - nó được hình thành như một sản phẩm phụ. Bản thân deuterium được hình thành trong quá trình chưng cất hydro lặp đi lặp lại trong các thiết bị đặc biệt. Công dụng của nó dựa trên khả năng làm chậm phản ứng tổng hợp neutron và phản ứng proton. Chính các đồng vị nước nặng và hydro là cơ sở để tạo ra bom hạt nhân và bom hydro.
Các thí nghiệm về việc mọi người sử dụng nước deuterium với số lượng nhỏ đã chỉ ra rằng nó không tồn tại lâu - việc rút hoàn toàn được quan sát thấy sau hai tuần. Nó không thể được sử dụng như một nguồn cung cấp độ ẩm cho sự sống, nhưng ý nghĩa kỹ thuật của nó đơn giản là rất lớn.
Nước tan chảy và công dụng của nó
Từ xa xưa, đặc tính của loại nước này đã được người dân xác định là có tác dụng chữa bệnh. Từ lâu, người ta đã nhận thấy rằng khi tuyết tan, động vật cố gắng uống nước từ những vũng nước tạo thành. Sau đó, cấu trúc và tác dụng sinh học của nó đối với cơ thể con người đã được nghiên cứu kỹ lưỡng.

Nước tan chảy, đặc điểm và tính chất của nó nằm ở giữa nước nhẹ thông thường và nước đá. Từ bên trong, nó được hình thành không chỉ bởi các phân tử mà còn bởi một tập hợp các cụm được hình thành bởi các tinh thể và khí. Nghĩa là, bên trong các khoảng trống giữa các phần cấu trúc của tinh thể có hydro và oxy. Nhìn chung, cấu trúc của nước tan giống với cấu trúc của băng - cấu trúc được bảo toàn. Các tính chất vật lý của oxit hydro này thay đổi một chút so với các loại thông thường. Tuy nhiên, tác dụng sinh học đối với cơ thể là tuyệt vời.
Khi nước đóng băng, phần đầu tiên biến thành băng, phần nặng hơn - đây là các đồng vị deuterium, muối và tạp chất. Vì vậy, lõi này nên được loại bỏ. Nhưng phần còn lại là nước sạch, có cấu trúc và tốt cho sức khỏe. Có tác dụng gì đối với cơ thể? Các nhà khoa học từ Viện nghiên cứu Donetsk đã đặt tên cho các loại cải tiến sau:
- Tăng tốc quá trình phục hồi.
- Tăng cường hệ thống miễn dịch.
- Ở trẻ em, sau khi hít phải nước này, cảm lạnh sẽ khỏi và khỏi, ho, sổ mũi,… khỏi.
- Hơi thở, tình trạng của thanh quản và màng nhầy được cải thiện.
- Sức khỏe chung của một người và hoạt động tăng lên.
Ngày nay, có một số người ủng hộ việc điều trị bằng nước tan chảy đã viết những đánh giá tích cực của họ. Tuy nhiên, có những nhà khoa học, trong đó có bác sĩ, lại không ủng hộ những quan điểm này. Họ tin rằng nguồn nước như vậy sẽ không gây hại gì nhưng cũng chẳng mang lại lợi ích gì nhiều.
Năng lượng
Tại sao tính chất của nước có thể thay đổi và phục hồi khi chuyển sang các trạng thái kết tụ khác nhau? Câu trả lời cho câu hỏi này như sau: hợp chất này có bộ nhớ thông tin riêng, ghi lại tất cả các thay đổi và dẫn đến việc khôi phục cấu trúc và đặc tính vào đúng thời điểm. Trường năng lượng sinh học mà phần nước đi qua (từ không gian) mang theo một nguồn năng lượng mạnh mẽ. Mô hình này thường được sử dụng trong điều trị. Tuy nhiên, từ quan điểm y tế, không phải loại nước nào cũng có thể có tác dụng hữu ích, kể cả thông tin.
Nước có cấu trúc - nó là gì?
Đây là nước có cấu trúc phân tử hơi khác một chút, cách sắp xếp các mạng tinh thể (giống như quan sát thấy ở băng), nhưng nó vẫn là chất lỏng (tan chảy cũng thuộc loại này). Trong trường hợp này, thành phần của nước và tính chất của nó, theo quan điểm khoa học, không khác với đặc tính của hydro oxit thông thường. Do đó, nước có cấu trúc không thể có tác dụng chữa bệnh rộng rãi như các nhà bí truyền và những người ủng hộ y học thay thế cho rằng nó.
Chất chính cho phép sự sống tồn tại trên hành tinh là nước. Nó là cần thiết trong bất kỳ điều kiện nào. Việc nghiên cứu tính chất của chất lỏng đã dẫn đến sự hình thành cả một ngành khoa học - thủy văn. Đối tượng nghiên cứu của hầu hết các nhà khoa học là Các tính chất vật lý và hóa học. Họ hiểu những đặc tính sau: nhiệt độ tới hạn, mạng tinh thể, tạp chất và các đặc tính riêng lẻ khác của một hợp chất hóa học.
Liên hệ với
Học
Công thức nướcđược mọi học sinh biết đến. Đây là ba cung đơn giản nhưng chúng chiếm tới 75% tổng khối lượng của mọi thứ trên hành tinh.
H2O- đây là hai nguyên tử và một - . Cấu trúc của phân tử có dạng thực nghiệm, đó là lý do tại sao tính chất của chất lỏng rất đa dạng, mặc dù thành phần đơn giản của nó. Mỗi phân tử được bao quanh bởi hàng xóm. Chúng được kết nối bởi một mạng tinh thể.
Sự đơn giản của cấu trúc cho phép chất lỏng tồn tại ở nhiều trạng thái kết tụ. Không một chất nào trên hành tinh có thể tự hào về điều này. H2O rất cơ động; về mặt này nó chỉ đứng sau không khí. Mọi người đều biết về vòng tuần hoàn của nước, sau khi bốc hơi khỏi bề mặt trái đất, mưa hoặc tuyết sẽ rơi ở một nơi rất xa. Kiểm soát khí hậu chính xác là do tính chất của chất lỏng, có thể tỏa nhiệt, trong khi bản thân nó thực tế không thay đổi nhiệt độ.
Tính chất vật lý
H2O và tính chất của nó phụ thuộc vào nhiều yếu tố quan trọng. Những cái chính:
- Tế bào tinh thể. Cấu trúc của nước, hay đúng hơn là mạng tinh thể của nó, được xác định bởi trạng thái kết tụ của nó. Nó có cấu trúc lỏng lẻo nhưng rất mạnh mẽ. Những bông tuyết có dạng lưới ở trạng thái rắn, nhưng ở trạng thái lỏng thông thường, nước không có cấu trúc tinh thể rõ ràng, chúng di động và dễ thay đổi.
- Cấu trúc của phân tử là một hình cầu. Nhưng ảnh hưởng của trọng lực làm cho nước có hình dạng của vật chứa nó. Trong không gian, nó sẽ có hình dạng chính xác về mặt hình học.
- Nước phản ứng với các chất khác, bao gồm cả những chất có cặp electron không chia sẻ, bao gồm rượu và amoniac.
- Có khả năng chịu nhiệt và dẫn nhiệt cao, nóng lên nhanh chóng và không nguội trong thời gian dài.
- Từ thời đi học người ta đã biết nhiệt độ sôi là 100 độ C. Các tinh thể xuất hiện trong chất lỏng khi nhiệt độ giảm xuống +4 độ, nhưng băng hình thành với mức giảm thậm chí còn lớn hơn. Điểm sôi phụ thuộc vào áp suất mà H2O được đặt vào. Có một thí nghiệm trong đó nhiệt độ của một hợp chất hóa học đạt tới 300 độ, chất lỏng không sôi mà làm tan chảy chì.
- Một tính chất quan trọng khác là sức căng bề mặt. Công thức nước cho phép nó rất bền. Các nhà khoa học nhận thấy rằng để phá vỡ nó cần phải có một lực có khối lượng hơn 100 tấn.
Hấp dẫn! H2O, được tinh chế khỏi tạp chất (chưng cất), không thể dẫn dòng điện. Tính chất này của hydro oxit chỉ xuất hiện khi có muối hòa tan trong đó.
Các tính năng khác
Băng là tình trạng duy nhất,đó là đặc tính của hydro oxit. Nó tạo thành các liên kết lỏng lẻo và dễ bị biến dạng. Ngoài ra, khoảng cách giữa các hạt tăng lên đáng kể khiến mật độ của băng thấp hơn nhiều so với chất lỏng. Điều này cho phép các hồ chứa không bị đóng băng hoàn toàn vào mùa đông, bảo toàn sự sống dưới lớp băng. Sông băng là nguồn cung cấp nước ngọt lớn.
Hấp dẫn! H2O có một điều kiện đặc biệt gọi là hiện tượng điểm ba. Đây là lúc cô ấy ở ba trạng thái của mình cùng một lúc. Điều kiện này chỉ có thể thực hiện được ở nhiệt độ 0,01 độ và áp suất 610 Pa.
Tính chất hóa học
Tính chất hóa học cơ bản:
- Nước được chia theo độ cứng, từ mềm, trung bình đến cứng. Chỉ tiêu này phụ thuộc vào hàm lượng muối magie và kali trong dung dịch. Ngoài ra còn có những chất thường xuyên ở dạng lỏng và một số có thể loại bỏ bằng cách đun sôi.
- Quá trình oxy hóa và khử. H2O ảnh hưởng đến các quá trình nghiên cứu trong hóa học xảy ra với các chất khác: nó hòa tan một số chất và phản ứng với các chất khác. Kết quả của bất kỳ thí nghiệm nào đều phụ thuộc vào việc lựa chọn đúng các điều kiện mà nó diễn ra.
- Ảnh hưởng đến các quá trình sinh hóa. Nước phần chính của bất kỳ tế bào nào, trong đó, cũng như trong môi trường, mọi phản ứng trong cơ thể đều diễn ra.
- Ở trạng thái lỏng, nó hấp thụ các khí không hoạt động. Các phân tử của chúng nằm giữa các phân tử H2O bên trong các hốc. Đây là cách clathrates được hình thành.
- Với sự trợ giúp của hydro oxit, các chất mới được hình thành không liên quan đến quá trình oxy hóa khử. Chúng ta đang nói về kiềm, axit và bazơ.
- Một đặc tính khác của nước là khả năng hình thành hydrat tinh thể. Oxit hydro không thay đổi. Trong số các hydrat phổ biến, có thể phân biệt được đồng sunfat.
- Nếu có dòng điện chạy qua mối nối thì phân tử có thể bị phân hủy thành khí.

Tầm quan trọng đối với một người
Cách đây rất lâu, con người đã nhận ra tầm quan trọng vô giá của chất lỏng đối với mọi sinh vật sống và toàn bộ hành tinh. . Không có cô ấy một người không thể sống và tuần . Tác dụng có lợi của chất phổ biến nhất này trên Trái đất là gì?
- Ứng dụng quan trọng nhất là sự hiện diện của nó trong cơ thể, trong tế bào, nơi diễn ra tất cả các phản ứng quan trọng nhất.
- Sự hình thành liên kết hydro có tác dụng có lợi cho sinh vật vì khi nhiệt độ thay đổi, chất lỏng trong cơ thể không bị đóng băng.
- Từ lâu con người đã sử dụng H2O cho nhu cầu hằng ngày, ngoài việc nấu nướng như giặt giũ, lau chùi, tắm rửa.
- Không có nhà máy công nghiệp nào có thể hoạt động mà không có chất lỏng.
- H2O – nguồn sống và sức khỏe, cô ấy là thuốc.
- Thực vật sử dụng nó ở tất cả các giai đoạn phát triển và cuộc sống của chúng. Với sự giúp đỡ của nó, chúng tạo ra oxy, một loại khí rất cần thiết cho sự sống của sinh vật.
Ngoài những đặc tính có lợi rõ ràng nhất, còn có nhiều đặc tính khác.

Tầm quan trọng của nước đối với con người
Nhiệt độ nguy hiểm
H2O, giống như mọi chất, có nhiệt độ gọi là quan trọng. Nhiệt độ tới hạn của nước được xác định bằng phương pháp làm nóng nó. Lên tới 374 độ C, chất lỏng được gọi là hơi; nó vẫn có thể trở lại trạng thái lỏng thông thường ở một áp suất nhất định. Khi nhiệt độ cao hơn điểm tới hạn này thì nước, với tư cách là một nguyên tố hóa học, sẽ biến thành khí không thể thu hồi được.
Ứng dụng trong hóa học
H2O được các nhà hóa học rất quan tâm do đặc tính chính của nó - khả năng hòa tan. Các nhà khoa học thường sử dụng nó để tinh chế các chất, từ đó tạo điều kiện thuận lợi cho việc tiến hành thí nghiệm. Trong nhiều trường hợp, nó cung cấp một môi trường trong đó việc thử nghiệm thí điểm có thể được thực hiện. Ngoài ra, bản thân H2O cũng tham gia vào các quá trình hóa học, ảnh hưởng đến thí nghiệm hóa học này hoặc thí nghiệm hóa học khác. Nó kết hợp với các chất phi kim loại và kim loại.
Ba bang
 Nước xuất hiện với con người ở ba bang, gọi là tập hợp. Đây là chất lỏng, nước đá và khí. Chất này giống nhau về thành phần nhưng khác nhau về tính chất. bạn
Nước xuất hiện với con người ở ba bang, gọi là tập hợp. Đây là chất lỏng, nước đá và khí. Chất này giống nhau về thành phần nhưng khác nhau về tính chất. bạn
Khả năng tái sinh là một đặc tính rất quan trọng của nước đối với toàn bộ hành tinh, do đó sự lưu thông của nó diễn ra.
So sánh cả ba trạng thái, một người thường thấy hợp chất hóa học ở dạng lỏng hơn. Nước không có mùi vị, và những gì cảm nhận được trong đó là do sự hiện diện của tạp chất, các chất hòa tan trong đó.
Các đặc tính chính của nước ở trạng thái lỏng là: sức mạnh to lớn, cho phép bạn mài đá và phá hủy đá, cũng như khả năng có bất kỳ hình dạng nào.
Khi các hạt nhỏ đóng băng, chúng giảm tốc độ và tăng khoảng cách, do đó cấu trúc băng xốp và có mật độ thấp hơn chất lỏng. Nước đá được sử dụng trong các thiết bị làm lạnh cho nhiều mục đích gia đình và công nghiệp khác nhau. Trong tự nhiên, băng chỉ gây ra sự tàn phá, rơi xuống dưới dạng mưa đá hoặc tuyết lở.
Khí là một tình trạng khác được hình thành khi không đạt được nhiệt độ tới hạn của nước. Thường ở nhiệt độ lớn hơn 100 độ, hoặc bốc hơi khỏi bề mặt. Trong tự nhiên, đây là những đám mây, sương mù và hơi nước. Sự hình thành khí nhân tạo đóng vai trò quan trọng trong tiến bộ công nghệ vào thế kỷ 19, khi động cơ hơi nước được phát minh.
Lượng chất trong tự nhiên
75% - một con số như vậy có vẻ rất lớn, nhưng đây là tất cả nước trên hành tinh, thậm chí cả nước ở các trạng thái tổng hợp khác nhau, trong các sinh vật sống và các hợp chất hữu cơ. Nếu chúng ta chỉ tính đến chất lỏng, tức là nước được tìm thấy ở biển và đại dương, cũng như nước ở dạng rắn - trong sông băng, thì tỷ lệ này sẽ là 70,8%.
Phân phối phần trăm một cái gì đó như thế này:
- biển và đại dương – 74,8%
- H2O từ các nguồn trong lành, phân bố không đều trên khắp hành tinh, chiếm 3,4% ở sông băng và chỉ 1,1% ở hồ, đầm lầy và sông.
- Nguồn ngầm chiếm khoảng 20,7% trong tổng số.
Đặc điểm của nước nặng
Chất tự nhiên - hydro xảy ra là ba đồng vị, oxy cũng tồn tại ở cùng một số dạng. Điều này giúp có thể tách deuterium và tritium ngoài nước uống thông thường.
Deuterium có dạng ổn định nhất, nó được tìm thấy trong tất cả các nguồn tự nhiên, nhưng với số lượng rất nhỏ. Chất lỏng có công thức này có một số điểm khác biệt so với chất lỏng đơn giản và nhẹ. Do đó, sự hình thành các tinh thể trong đó đã bắt đầu ở nhiệt độ 3,82 độ. Nhưng điểm sôi cao hơn một chút - 101,42 độ C. Nó có mật độ cao hơn và khả năng hòa tan các chất giảm đáng kể. Nó cũng được chỉ định bởi một công thức khác (D2O).
Hệ thống sống phản ứng xấu cho một hợp chất hóa học như vậy. Chỉ một số loại vi khuẩn có thể thích nghi với cuộc sống trong đó. Con cá đã không sống sót sau một thí nghiệm như vậy. Trong cơ thể con người, deuterium có thể tồn tại trong vài tuần và sau đó bị đào thải mà không gây hại.
Quan trọng! Uống nước deuterium bị cấm!
Tính chất độc đáo của nước. - Chỉ.
Phần kết luận
Nước nặng được sử dụng rộng rãi trong ngành công nghiệp hạt nhân và hạt nhân, còn nước thông thường được sử dụng ở mọi nơi.
Hydro.
Hydro là chất khí nhẹ, không màu, không mùi. Một phân tử hydro bao gồm hai nguyên tử được nối với nhau bằng liên kết cộng hóa trị không phân cực.
| Biên lai: 1.Trong công nghiệp: Phương pháp chuyển đổi.Đầu tiên, khí nước thu được bằng cách cho hơi nước đi qua cốc nóng ở 1000 °C: C + H 2 O -tà CO + H 2. Sau đó carbon monoxide (II) bị oxy hóa thành carbon monoxide (IV) bằng cách cho hỗn hợp khí nước với hơi nước dư thừa qua chất xúc tác Fe 2 O 3 được nung nóng đến 400–450 ° C: CO + H 2 O = CO 2 + H 2. Oxy hóa metan bằng hơi nước: CH 4 + 2H 2 O –(t, Ni)à4H 2 + CO 2 Phân hủy nhiệt metan ở 1200 °C: CH 4 -tà C + 2H 2 Điện phân dung dịch muối ăn hoặc natri hydroxit: (NaOH) + 2H 2 O – dòng điện 2H 2 + O 2 2NaCl + 2H 2 O – dòng điện H 2 + Cl 2 + 2NaOH; 2. Trong phòng thí nghiệm: Zn + 2HCl à ZnCl 2 + H 2 2Al + 2NaOH + 6H 2 O = 2Na + 3H 2 ; Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2. | Của cải: 1. Với kim loại: H 2 + 2Na -tà2NaH H 2 + Ca -tà CaH 2 2. Với phi kim: 2H 2 + O 2 à 2H 2 O H 2 + Cl 2 -hvà 2HCl 3H 2 + N 2 -t, p , cat.à 2NH 3 H 2 + S à H 2 S 3. Với oxit kim loại (không hoạt động) và phi kim: CuO + H 2 à Cu + H 2 O 2NO + 2H 2 = N 2 + 2H 2 O . |
Hợp chất hydro của kim loại và phi kim loại.
1. Hiđrua ion: Điều chế: H 2 + 2Na -tà2NaH
Tính chất: bị phân hủy bởi nước và axit:
NaH + H 2 O à NaOH + H 2
CaH 2 + 2HCl à CaCl 2 + 2H 2
2. Hợp chất hydro cộng hóa trị:
Tất cả các loại khí ngoại trừ nước (liên kết hydro).
Không ổn định: phosphine và silane.
Tính chất chính của nó là: amoniac.
Tính chất lưỡng tính được thể hiện bởi: nước.
Axit tạo thành trong dung dịch nước: hydro sunfua và hydro halogenua.
Nước.
Các phân tử nước được kết nối bằng liên kết hydro: nH 2 O = (H 2 O) n, do đó nước là chất lỏng, không giống như các chất tương tự ở dạng khí H 2 S, H 2 Se và H 2 Te.
Của cải:
1. Với kim loại:
a) Đất kiềm và kiềm (trừ berili và magie): 2Na + 2H 2 O = 2NaOH + H 2
b) Các kim loại còn lại trong dãy hoạt động đến H có thể bị oxi hóa bởi hơi nước thành oxit ở nhiệt độ cao: Fe + 4H 2 O-tà Fe 3 O 4 + 4H 2
2. Với oxit của kim loại kiềm và kim loại kiềm thổ: H 2 O + CaO = Ca(OH) 2
3. Với oxit axit của axit hòa tan: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
4. Thủy phân muối, hợp chất nhị phân của kim loại và phi kim:
2CuSO 4 + 2H 2 O ⇄ (CuOH) 2 SO 4 + H 2 SO 4
Al 2 S 3 + 6H 2 O à 2Al(OH) 3 + 3H 2 S
Ca 3 P 2 + 6H 2 O à 3Ca(OH) 2 + 2РН 3
PCl 5 + 4H 2 O à H 3 PO 4 + 5HCl
Ứng dụng của hydro
Việc sử dụng hydro dựa trên các tính chất vật lý và hóa học của nó:
- là một loại khí nhẹ, nó được dùng để bơm bóng bay (trộn với heli);
- ngọn lửa oxy-hydro được sử dụng để thu được nhiệt độ cao khi hàn kim loại;
- như một chất khử, nó được sử dụng để thu được kim loại (molypden, vonfram, v.v.) từ oxit của chúng;
- để sản xuất amoniac và nhiên liệu lỏng nhân tạo, để hydro hóa chất béo.
Các nguyên tố thuộc nhóm IVA.

Carbon.
1. Chất đơn giản. Nó có một số sửa đổi đẳng hướng: kim cương, than chì, carbyne, fullerene.
Kim cương– là chất kết tinh, trong suốt, khúc xạ tia sáng mạnh, rất cứng, không dẫn điện và dẫn nhiệt kém. Mỗi nguyên tử cacbon ở trạng thái lai hoá sp3.
Than chì– một chất màu xám mềm có ánh kim loại yếu, sờ vào thấy nhờn, dẫn điện. Các nguyên tử carbon ở trạng thái lai hóa sp2 và liên kết thành các lớp phẳng gồm các hình lục giác nối với nhau bằng các cạnh, giống như tổ ong.
Than chì là dạng biến đổi đẳng hướng ổn định nhất của cacbon ở nhiệt độ phòng.
cacbin– Bột màu xám mịn kết tinh, chất bán dẫn. Các tinh thể của nó bao gồm các chuỗi tuyến tính của các nguyên tử carbon được kết nối bằng liên kết ba và đơn xen kẽ, hoặc liên kết đôi, carbon ở trạng thái lai sp: -С≡С-С≡С-С≡С-С≡С-
Về độ cứng, carbyne vượt trội hơn than chì, nhưng kém hơn đáng kể so với kim cương.
Fulleren - một dạng biến đổi cacbon nhân tạo, bao gồm các phân tử C 60, C 70, .... C1020. Các phân tử này bao gồm các nguyên tử cacbon được sắp xếp thành các hình ngũ giác và hình lục giác có các cạnh chung. Đây là những chất màu đen có ánh kim loại có tính chất bán dẫn. Ở áp suất khoảng 2·10 5 atm và nhiệt độ phòng, fullerene biến thành kim cương.
Tính chất cacbon:
| Tương tác với flo: carbon có độ phản ứng thấp hơn các halogen, nó chỉ phản ứng với flo. | C + 2F 2 = CF 4. |
| Tương tác với oxy: | 2C + O 2 (không đủ) = 2CO (cacbon monoxit), C + O 2 (dư) = CO 2 (cacbon dioxide). |
| Tương tác với các phi kim loại khác: không tương tác với nitơ và phốt pho. | C + 2S = CS 2 C + 2H 2 –t, Nià CH 4 Ca + 2C = CaC 2 3C + 4Al = Al 4 C 3 |
| Tương tác với nước: khi hơi nước đi qua than nóng sẽ tạo thành khí cacbon monoxit (II) và hydro: | C + H 2 O = CO + H 2. |
| Tính khử: cacbon có khả năng khử nhiều kim loại khỏi oxit của chúng: | 2ZnO + C –tà 2Zn + CO 4C + Fe 3 O 4 –tà 3Fe + 4CO |
| Axit sulfuric và nitric đậm đặc, khi đun nóng, sẽ oxy hóa carbon thành carbon monoxide (IV): | C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O; C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O. |
cacbua - đây là những hợp chất của cacbon với kim loại.
Oxit cacbon.
| CO | CO2 | |
| đặc trưng | carbon monoxide – b\c, b\z, độc | cacbon dioxit - b/c, b/z |
| Phân tử carbon monoxide (II) có cấu trúc tuyến tính. Một liên kết ba được hình thành giữa các nguyên tử carbon và oxy. | Phân tử CO 2 có dạng mạch thẳng, kiểu lai cacbon là sp 2 | |
| Loại oxit | không tạo muối | axit |
| CO + NaOH = HCOONa (natri formate) 2CO + O 2 = 2CO 2 CO + H 2 = C + H 2 O CO + Cl 2 = COCl 2 (phosgene) CO + CuO = Cu + CO 2 | C + CO2 = 2CO. 2Mg + CO 2 = 2MgO + C. Oxit axit điển hình. Na 2 O + CO 2 = Na 2 CO 3, 2NaOH + CO 2 = Na 2 CO 3 + H 2 O, NaOH + CO 2 = NaHCO 3. Phản ứng định tính để phát hiện carbon dioxide là độ đục của nước vôi: Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O. | |
| Biên lai | 1) Được hình thành trong các máy tạo khí khi không khí đi qua than nóng: C + O 2 = CO 2, CO 2 + C = 2CO. 2) Thu được bằng cách phân hủy nhiệt axit formic hoặc axit oxalic với sự có mặt của axit sunfuric đậm đặc: HCOOH = H 2 O + CO, H 2 C 2 O 4 = CO + CO 2 + H 2 O | Khí CO2 thu được khi đốt đá vôi: CaCO 3 = CaO + CO 2, hoặc do tác dụng của axit mạnh với cacbonat và bicarbonat: CaCO 3 +2HCl = CaCl 2 +H 2 O + CO 2, NaHCO 3 + HCl = NaCl + H2O +CO2. |

Axit cacbonic H 2 CO 3
Khi carbon dioxide hòa tan trong nước, nó tạo thành một chất rất yếu axit cacbonic H2CO3.
Khí cacbonic trong nước chủ yếu tồn tại ở dạng phân tử CO 2 ngậm nước và chỉ ở một mức độ nhỏ dưới dạng axit cacbonic. Trong trường hợp này, trạng thái cân bằng được thiết lập trong dung dịch:
CO 2 (g) + H 2 O ⇄ CO 2 H 2 O (dung dịch) ⇄ H 2 CO 3 ⇄ H + + HCO 3 -
Axit cacbonic là một axit yếu, không ổn định, không thể tách khỏi dung dịch nước ở trạng thái tự do.

cacbonat.
1) Cacbonat kim loại ( ngoại trừ kiềm) phân hủy khi đun nóng:
CuCO3 – tà CuO + CO 2
2) Khi carbon dioxide đi qua, hydrocarbonat được hình thành từ cacbonat:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2.
3) Hydrocacbonat phân hủy thành cacbonat: 2NaHCO 3 – tà Na 2 CO 3 + H 2 O + CO 2 .
4) Cacbonat và bicarbonat tham gia phản ứng trao đổi:
a) với axit mạnh (phản ứng định tính với cacbonat):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
b) với muối và bazơ hòa tan, nếu tạo thành kết tủa:
Na 2 CO 3 + Ba(OH) 2 = BaCO 3 ↓+ 2NaOH
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓+ 2NaCl
5) Hydrocacbonat phản ứng với kiềm tạo thành muối trung bình:
KNSO 3 + KOH = K 2 CO 3 + H 2 O
Silicon.
| Nằm trong nhóm IV của bảng tuần hoàn. Có 4 electron ở lớp ngoài cùng, có cấu hình electron 3s 2 3p 2. Hiển thị trạng thái oxy hóa -4, +2, +4. | Nguyên tố phổ biến thứ hai trên Trái đất sau oxy. Chỉ tồn tại ở dạng hợp chất. Hợp chất silicon quan trọng nhất- SiO 2 oxit tạo thành một lượng lớn các chất tự nhiên - đá tinh thể, thạch anh, silic. SiO 2 cần thiết cho sự sống của thực vật và động vật. Nó mang lại sức mạnh cho thân cây và lớp phủ bảo vệ động vật. Nhờ có Ngài mà lau sậy, lau sậy, đuôi ngựa đứng vững như lưỡi lê, lá cói sắc cắt như dao, rơm rạ trên ruộng cắt gai như kim, thân cây ngũ cốc khỏe đến mức không cho đồng ruộng trên đồng nào chịu nổi. nằm tránh mưa gió. Vảy cá, vỏ côn trùng, cánh bướm, lông chim và lông động vật rất bền vì chúng có chứa silica. |
Tính chất vật lý. Chất này có màu xám đen ánh kim loại, khá dễ vỡ. Điểm nóng chảy 1415 °C, mật độ 2,33 g/cm3. Chất bán dẫn. Không giống như kim loại, độ dẫn điện của nó tăng khi nhiệt độ tăng. Các tấm pin mặt trời được lắp đặt trên vệ tinh, tàu vũ trụ và trạm, chuyển đổi năng lượng mặt trời thành năng lượng điện. Họ sử dụng tinh thể bán dẫn, chủ yếu là silicon.
Pin mặt trời silicon có thể chuyển đổi tới 10% năng lượng mặt trời hấp thụ thành điện năng.
Tính chất hóa học:
Silicon là một phi kim loại điển hình; nó có thể là chất oxy hóa và chất khử.
| Tương tác với halogen: chỉ tương tác trực tiếp với flo. Phản ứng với clo khi đun nóng. | Si + 2F 2 = SiF 4 Si + 2Cl 2 -tà SiCl 4 |
| Tương tác với oxy | Si + O 2 -tàSiO 2 |
| Tương tác với các phi kim loại khác: Không tương tác với hydro. | Si + C -tàSiC 3Si + 2N 2 = Si 3 N 4 |
| Tương tác với hydro halogenua. Nó phản ứng với hydro florua trong điều kiện bình thường, với hydro clorua - ở 300 ° C, với hydro bromua - ở 500 ° C. | Si + 4HF = SiF4 + 2H 2 |
| Tương tác với kim loại: tạo thành silicua. | 2Ca + Si = Ca 2 Si canxi silicide Si + 2Mg = Mg 2 Si Chất diệt silic dễ bị phân hủy bởi nước hoặc axit, giải phóng hợp chất khí hydro của silic - silan: Mg 2 Si + 2H 2 SO 4 = 2MgSO 4 + SiH 4 Không giống như hydrocarbon, silan trong không khí tự bốc cháy và cháy tạo thành silicon dioxide và nước: SiH 4 + 20 2 = SiO 2 + 2H 2 O Khả năng phản ứng của silan tăng lên so với metan CH 4 được giải thích là do silicon có kích thước nguyên tử lớn hơn hơn cacbon nên liên kết hóa học -H yếu hơn liên kết C-H. |
| Tương tác với axit. Chịu được axit, chỉ tương tác với hỗn hợp axit hydrofluoric và axit nitric. | 3Si + 4HNO3 + 18HF = 3H2 + 4NO + 8H2O |
| Hòa tan trong kiềm, tạo thành silicat và hydro: | Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2 |
Thu được silicon.
Thuốc diệt silic – hợp chất của silic với kim loại trong đó silic có trạng thái oxi hóa -4.
Chất diệt silic của kim loại kiềm và kiềm thổ được đặc trưng bởi loại ion liên kết thì chúng có hoạt tính hóa học. Chúng dễ bị phân hủy bởi nước hoặc axit loãng khi giải phóng silan: Ca 2 Si + 2H 2 SO 4 = 2CaSO 4 + SiH 4.
Trong silic phi kim loại có liên kết cộng hóa trị. Trong số các loại silic như vậy, quan trọng nhất là silicon cacbua - carborundum SiC, có cấu trúc của kim cương, nó được đặc trưng bởi độ cứng và điểm nóng chảy cao cũng như khả năng kháng hóa chất cao.
Chất diệt silic thu được bằng cách nung chảy các chất đơn giản hoặc khử hỗn hợp oxit với cốc trong lò điện: 2Mg + Si = Mg 2 Si,
2MgO + SiO 2 + 4C = Mg 2 Si + 4CO.
Silane SiH4. (monosilan).
Silic(IV) oxit- oxit axit.
Trong tự nhiên – cát sông, thạch anh.
Không phản ứng với nước - vì axit silicic không hòa tan.
2) Khi nung chảy, nó phản ứng với chất kiềm: SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
3) Phản ứng với các oxit bazơ: SiO 2 + MgO -tàMgSiO 3 và cacbonat kim loại kiềm: SiO 2 + K 2 CO 3 -tà K 2 SiO 3 + CO 2 trong quá trình nung chảy.
4) Hòa tan từ axit chỉ có huỳnh quang: SiO 2 + 6HF = H 2 + 2H 2 O
5) Ở nhiệt độ trên 1000°C, nó phản ứng với các kim loại hoạt động tạo thành silic: SiO 2 + 2Mg = Si + 2MgO
hoặc dư chất khử - silicua: SiO 2 + 4Mg = Mg 2 Si + 2MgO.
6) Tương tác với phi kim loại.
Phản ứng với hydro: SiO 2 + 2H 2 = Si + 2H 2 O,
Tương tác với cacbon: SiO 2 + 3C = SiC + 2CO.
Axit silicic.
Nó có cấu trúc và thành phần polyme xSiO 2 yH 2 O. Sự tồn tại của axit orthosilicon H 4 SiO 4 và axit metasilicon H 2 SiO 3 đã được chứng minh trong dung dịch nước.

Biên lai: chỉ gián tiếp, từ muối: Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
Na 2 SiO 3 + 2H 2 O + 2CO 2 = 2NaHCO 3 + H 2 SiO 3 ↓,
Của cải: 1) Hòa tan trong kiềm đậm đặc: H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
2) Phân hủy khi đun nóng: H 2 SiO 3 -tàSiO 2 + H 2 O
Silicat.
Hầu hết đều không tan trong nước, ngoại trừ natri và kali silicat, chúng được gọi là “thủy tinh lỏng”. Dung dịch nước của họ là keo silicat nổi tiếng.
Biên lai: 1) hòa tan silicon, axit silicic hoặc oxit trong kiềm:
H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2
SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
2) Sự kết hợp của các oxit: CaO + SiO 2 -tà CaSiO 3
3) Bằng phản ứng tổng hợp silicon dioxide với cacbonat: SiO 2 + CaC0 3 = CaSiO 3 + C0 2
4) Tương tác của muối: K 2 SiO 3 + CaCl 2 = CaSiO 3 + 2KCl
Từ dung dịch silicat, do tác dụng của các axit mạnh hơn - hydrochloric, sulfuric, acetic và thậm chí carbonic, thu được axit silicic H 2 SiO 3:
K 2 SiO 3 + 2HCl = 2KSl + H 2 SiO 3
Vì vậy H 2 SiO 3 là axit rất yếu. Nó không hòa tan trong nước và rơi ra khỏi hỗn hợp phản ứng dưới dạng kết tủa dạng keo, đôi khi nén chặt lấp đầy toàn bộ thể tích dung dịch, biến nó thành một khối bán rắn tương tự như thạch hoặc thạch. Khi khối này khô đi, một chất có độ xốp cao được hình thành - silica gel, được sử dụng rộng rãi làm chất hấp phụ - chất hấp thụ các chất khác.
Trước hết, hãy nhớ rằng kim loại thường được chia thành ba nhóm:
1) Kim loại phản ứng: Những kim loại này bao gồm tất cả các kim loại kiềm, kim loại kiềm thổ, cũng như magiê và nhôm.
2) Kim loại có hoạt tính trung gian: bao gồm các kim loại nằm giữa nhôm và hydro trong dãy hoạt động.
3) Kim loại có hoạt tính thấp: kim loại nằm trong dãy hoạt động bên phải của hydro.
Trước hết, bạn cần nhớ rằng các kim loại có hoạt tính thấp (tức là những kim loại nằm sau hydro) không phản ứng với nước trong bất kỳ điều kiện nào.
Kim loại kiềm và kiềm thổ phản ứng với nước trong mọi điều kiện (ngay cả ở nhiệt độ bình thường và ở nhiệt độ lạnh), và phản ứng đi kèm với việc giải phóng hydro và hình thành hydroxit kim loại. Ví dụ:
2Na + 2H 2 O = 2NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
Magiê, do được bao phủ bởi một màng oxit bảo vệ, chỉ phản ứng với nước khi đun sôi. Khi đun nóng trong nước, màng oxit bao gồm MgO bị phá hủy và magie bên dưới bắt đầu phản ứng với nước. Trong trường hợp này, phản ứng còn đi kèm với sự giải phóng hydro và sự hình thành hydroxit kim loại, tuy nhiên, trong trường hợp magiê là không hòa tan:
Mg + 2H 2 O = Mg(OH) 2 ↓ + H 2
Nhôm, giống như magie, được phủ một lớp màng oxit bảo vệ, nhưng trong trường hợp này nó không thể bị phá hủy khi đun sôi. Để loại bỏ nó, cần phải làm sạch cơ học (bằng một số loại chất mài mòn) hoặc phá hủy hóa học bằng kiềm, dung dịch muối thủy ngân hoặc muối amoni:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
Kim loại có hoạt tính trung bình chỉ phản ứng với nước khi nước ở trạng thái hơi nước quá nhiệt. Bản thân kim loại phải được nung đến nhiệt độ nóng đỏ (khoảng 600-800 o C). Không giống như kim loại hoạt động, kim loại có hoạt tính trung gian phản ứng với nước tạo thành oxit kim loại thay vì hydroxit. Sản phẩm khử trong trường hợp này là hydro.
SỰ ĐỊNH NGHĨA
Nước– hydro oxit là một hợp chất nhị phân có tính chất vô cơ.
Công thức – H 2 O. Khối lượng mol – 18 g/mol. Nó có thể tồn tại ở ba trạng thái kết tụ - lỏng (nước), rắn (nước đá) và khí (hơi nước).
Tính chất hóa học của nước
Nước là dung môi phổ biến nhất. Có sự cân bằng trong dung dịch nước, đó là lý do tại sao nước được gọi là ampholyte:
H 2 O ↔ H + + OH — ↔ H 3 O + + OH — .
Dưới tác dụng của dòng điện, nước bị phân hủy thành hydro và oxy:
H2O = H2 + O2.
Ở nhiệt độ phòng, nước hòa tan các kim loại hoạt động tạo thành kiềm và hydro cũng được giải phóng:
2H 2 O + 2Na = 2NaOH + H 2.
Nước có thể tương tác với các hợp chất flo và interhalua, và trong trường hợp thứ hai phản ứng xảy ra ở nhiệt độ thấp:
2H 2 O + 2F 2 = 4HF + O 2.
3H 2 O +IF 5 = 5HF + HIO 3.
Muối tạo thành bởi bazơ yếu và axit yếu bị thủy phân khi hòa tan trong nước:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S.
Nước có thể hòa tan một số chất, kim loại và phi kim khi đun nóng:
4H 2 O + 3Fe = Fe 3 O 4 + 4H 2;
H 2 O + C ↔ CO + H 2 .
Nước khi có mặt axit sunfuric sẽ tham gia phản ứng tương tác (hydrat hóa) với hydrocacbon không bão hòa - anken với sự hình thành rượu đơn chức bão hòa:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH.
Tính chất vật lý của nước
Nước là chất lỏng trong suốt (n.s.). Momen lưỡng cực là 1,84 D (do sự chênh lệch lớn về độ âm điện của oxy và hydro). Nước có nhiệt dung riêng cao nhất trong số tất cả các chất ở trạng thái tổng hợp lỏng và rắn. Nhiệt dung riêng của nước nóng chảy là 333,25 kJ/kg (0 C), hóa hơi là 2250 kJ/kg. Nước có thể hòa tan các chất phân cực. Nước có sức căng bề mặt cao và điện thế bề mặt âm.
Lấy nước
Nước thu được bằng phản ứng trung hòa, tức là phản ứng giữa axit và kiềm:
H 2 SO 4 + 2KOH = K 2 SO 4 + H 2 O;
HNO 3 + NH 4 OH = NH 4 NO 3 + H 2 O;
2CH 3 COOH + Ba(OH) 2 = (CH 3 COO) 2 Ba + H 2 O.
Một trong những cách để thu được nước là khử kim loại bằng hydro từ oxit của chúng:
CuO + H 2 = Cu + H 2 O.
Ví dụ về giải quyết vấn đề
VÍ DỤ 1
| Bài tập | Cần lấy bao nhiêu nước để pha chế dung dịch 5% từ dung dịch axit axetic 20%? |
| Giải pháp | Theo định nghĩa về phần khối lượng của một chất, dung dịch axit axetic 20% là 80 ml dung môi (nước) 20 g axit và dung dịch axit axetic 5% là 95 ml dung môi (nước) 5 g. của axit. Hãy làm một tỷ lệ: x = 20 × 95/5 = 380. Những thứ kia. dung dịch mới (5%) chứa 380 ml dung môi. Được biết, dung dịch ban đầu chứa 80 ml dung môi. Do đó, để thu được dung dịch axit axetic 5% từ dung dịch 20%, bạn cần thêm: 380-80 = 300ml nước. |
| Trả lời | Bạn cần 300ml nước. |
VÍ DỤ 2
| Bài tập | Khi đốt cháy một chất hữu cơ nặng 4,8 g thì thu được 3,36 lít khí cacbonic (CO) và 5,4 g nước. Mật độ hydro của chất hữu cơ là 16. Xác định công thức của chất hữu cơ. |
| Giải pháp | Khối lượng mol của carbon dioxide và nước, được tính toán bằng bảng nguyên tố hóa học của D.I. Mendeleev – lần lượt là 44 và 18 g/mol. Tính khối lượng chất có trong sản phẩm phản ứng: n(CO 2) = V(CO 2) / Vm; n(H 2 O) = m(H 2 O) / M(H 2 O); n(CO 2) = 3,36 / 22,4 = 0,15 mol; n(H 2 O) = 5,4 / 18 = 0,3 mol. Xét phân tử CO 2 chứa 1 nguyên tử cacbon và phân tử H 2 O chứa 2 nguyên tử hydro thì lượng chất và khối lượng của các nguyên tử này sẽ bằng: n(C) = 0,15 mol; n(H) = 2×0,3 mol; m(C) = n(C)× M(C) = 0,15 × 12 = 1,8 g; m(N) = n(N)× M(N) = 0,3 × 1 = 0,3 g. Hãy xác định xem chất hữu cơ có chứa oxy hay không: m(O) = m(C x H y O z) – m(C) – m(H) = 4,8 – 0,6 – 1,8 = 2,4 g. Khối lượng chất của nguyên tử oxy: n(O) = 2,4 / 16 = 0,15 mol. Khi đó, n(C): n(H): n(O) = 0,15: 0,6: 0,15. Chia cho giá trị nhỏ nhất ta được n(C):n(H): n(O) = 1:4:1. Do đó công thức của chất hữu cơ là CH 4 O. Khối lượng mol của chất hữu cơ tính được sử dụng bảng nguyên tố hóa học D.I. Mendeleev – 32 g/mol. Khối lượng mol của một chất hữu cơ, được tính bằng mật độ hydro của nó: M(C x H y O z) = M(H 2) × D(H 2) = 2 × 16 = 32 g/mol. Nếu công thức của một chất hữu cơ thu được từ sản phẩm cháy và mật độ sử dụng hydro khác nhau thì tỉ số khối lượng mol sẽ lớn hơn 1. Hãy kiểm tra điều này: M(C x H y O z) / M(CH 4 O) = 1. Do đó, công thức của chất hữu cơ là CH 4 O. |
| Trả lời | Công thức của chất hữu cơ là CH4O. |