Najpomembnejša snov našega planeta, edinstvena po svojih lastnostih in sestavi, je seveda voda. Navsezadnje je zahvaljujoč njej, da obstaja življenje na Zemlji, medtem ko na drugih danes znanih predmetih sončnega sistema ni življenja. Trdno, tekoče, v obliki pare - vse je potrebno in pomembno. Voda in njene lastnosti so predmet študija celotne znanstvene discipline - hidrologije.
Količina vode na planetu
Če upoštevamo indikator količine tega oksida v vseh agregatnih stanjih, potem je približno 75% celotne mase na planetu. Pri tem je treba upoštevati vezano vodo v organskih spojinah, živih bitjih, mineralih in drugih elementih.
Če upoštevamo samo tekoče in trdno stanje vode, se številka zniža na 70,8 %. Poglejmo, kako so ti odstotki porazdeljeni, kje je zadevna snov vsebovana.
- Na Zemlji je 360 milijonov km 2 slane vode v oceanih in morjih ter slanih jezerih.
- Sladka voda je porazdeljena neenakomerno: 16,3 milijona km 2 je je obdanih z ledom v ledenikih Grenlandije, Arktike in Antarktike.
- 5,3 milijona km 2 vodikovega oksida je skoncentriranega v svežih rekah, močvirjih in jezerih.
- Podzemna voda znaša 100 milijonov m3.
Zato lahko astronavti iz daljnega vesolja vidijo Zemljo v obliki modre krogle z redkimi vključki kopnega. Voda in njene lastnosti, poznavanje njenih strukturnih značilnosti so pomembni elementi znanosti. Poleg tega je v zadnjem času človeštvo začelo doživljati očitno pomanjkanje sveže vode. Morda bo takšno znanje pomagalo pri reševanju tega problema.
Sestava vode in molekularna struktura
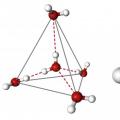
Če upoštevamo te kazalnike, bodo lastnosti, ki jih ima ta neverjetna snov, takoj postale jasne. Tako je molekula vode sestavljena iz dveh atomov vodika in enega atoma kisika, zato ima empirično formulo H 2 O. Poleg tega imajo elektroni obeh elementov pomembno vlogo pri izgradnji same molekule. Poglejmo, kakšna je zgradba vode in njene lastnosti.

Očitno je, da je vsaka molekula usmerjena okoli druge in skupaj tvorita skupno kristalno mrežo. Zanimivo je, da je oksid zgrajen v obliki tetraedra – v središču je atom kisika, okoli njega pa asimetrično dva para elektronov in dva atoma vodika. Če narišete črte skozi središča atomskih jeder in jih povežete, boste dobili točno tetraedrično geometrijsko obliko.
Kot med središčem atoma kisika in vodikovimi jedri je 104,5 0 C. Dolžina vezi O-H = 0,0957 nm. Prisotnost elektronskih parov kisika in njegova večja elektronska afiniteta v primerjavi z vodikom zagotavljata nastanek negativno nabitega polja v molekuli. Nasprotno pa vodikova jedra tvorijo pozitivno nabit del spojine. Tako se izkaže, da je molekula vode dipol. Ta določa, kakšna je lahko voda, njene fizikalne lastnosti pa so odvisne tudi od zgradbe molekule. Za živa bitja imajo te lastnosti ključno vlogo.
Osnovne fizikalne lastnosti
Ti običajno vključujejo kristalno mrežo, vrelišče in tališče ter posebne individualne značilnosti. Razmislimo o vseh.
- Struktura kristalne mreže vodikovega oksida je odvisna od agregatnega stanja. Lahko je trdno - led, tekoče - bazična voda v normalnih pogojih, plinasto - para, ko se temperatura vode dvigne nad 100 0 C. Led tvori čudovite vzorčaste kristale. Mreža kot celota je ohlapna, vendar je povezava zelo močna in gostota nizka. To lahko vidite na primeru snežink ali ledenih vzorcev na steklu. V navadni vodi mreža nima stalne oblike, spreminja se in prehaja iz enega stanja v drugo.
- Molekula vode v vesolju ima pravilno sferično obliko. Vendar se pod vplivom zemeljske gravitacije popači in v tekočem stanju dobi obliko posode.
- Dejstvo, da je vodikov oksid po strukturi dipol, določa naslednje lastnosti: visoko toplotno prevodnost in toplotno kapaciteto, kar se kaže v hitrem segrevanju in dolgotrajnem ohlajanju snovi, sposobnost orientacije tako ionov kot posameznih elektronov in spojin okoli sebe. . Zaradi tega je voda univerzalno topilo (tako polarno kot nevtralno).
- Sestava vode in struktura molekule pojasnjujeta sposobnost te spojine, da tvori več vodikovih vezi, vključno z drugimi spojinami, ki imajo osamljene elektronske pare (amoniak, alkohol in drugi).
- Vrelišče tekoče vode je 100 0 C, kristalizacija se pojavi pri +4 0 C. Pod tem indikatorjem je led. Če povečate pritisk, se bo vrelišče vode močno povečalo. Torej, pri visokih atmosferah je v njem možno stopiti svinec, vendar ne bo niti zavrel (nad 300 0 C).
- Lastnosti vode so zelo pomembne za živa bitja. Na primer, ena najpomembnejših je površinska napetost. To je nastanek tanke zaščitne folije na površini vodikovega oksida. Govorimo o tekoči vodi. Ta film je zelo težko zlomiti z mehanskim delovanjem. Znanstveniki so ugotovili, da bo potrebna sila, enaka teži 100 ton. Kako ga opaziti? Film je očiten, ko voda počasi kaplja iz pipe. Vidi se, da je kot v nekakšni lupini, ki je raztegnjena do določene meje in teže in se odlepi v obliki okrogle kapljice, rahlo popačene od gravitacije. Zahvaljujoč površinski napetosti lahko številni predmeti lebdijo na površini vode. Po njem se lahko prosto gibljejo žuželke s posebnimi prilagoditvami.
- Voda in njene lastnosti so nenavadne in edinstvene. Po organoleptičnih indikatorjih je ta spojina brezbarvna tekočina brez okusa in vonja. Okus vode imenujemo minerali in druge sestavine, raztopljene v njej.
- Električna prevodnost vodikovega oksida v tekočem stanju je odvisna od tega, koliko in katere soli so v njem raztopljene. Destilirana voda, ki ne vsebuje nobenih primesi, ne prevaja električnega toka.
Led je posebno stanje vode. V strukturi tega stanja so molekule med seboj povezane z vodikovimi vezmi in tvorijo lepo kristalno mrežo. Vendar je precej nestabilen in se zlahka razcepi, stopi, torej deformira. Med molekulami je veliko praznin, katerih dimenzije presegajo dimenzije samih delcev. Zaradi tega je gostota ledu manjša od gostote tekočega vodikovega oksida.

To je zelo pomembno za reke, jezera in druga sladkovodna telesa. Voda v njih namreč pozimi ne zmrzne popolnoma, ampak je le prekrita z gosto skorjo svetlejšega ledu, ki priplava na vrh. Če ta lastnost ne bi bila značilna za trdno stanje vodikovega oksida, bi rezervoarji zmrznili. Življenje pod vodo bi bilo nemogoče.
Poleg tega je trdno stanje vode velikega pomena kot vir ogromnih količin sveže pitne vode. To so ledeniki.
Posebno lastnost vode lahko imenujemo pojav trojne točke. To je stanje, v katerem lahko sočasno obstajajo led, para in tekočina. To zahteva naslednje pogoje:
- visok tlak - 610 Pa;
- temperatura 0,01 0 C.
Bistrost vode se razlikuje glede na tujke. Tekočina je lahko popolnoma prozorna, opalescentna ali motna. Valovi rumene in rdeče barve se absorbirajo, vijolični žarki prodrejo globoko.

Kemijske lastnosti
Voda in njene lastnosti so pomembno orodje pri razumevanju številnih življenjskih procesov. Zato so bili zelo dobro raziskani. Tako hidrokemijo zanimajo voda in njene kemijske lastnosti. Med njimi so naslednji:
- Togost. To lastnost je razložena s prisotnostjo kalcijevih in magnezijevih soli ter njihovih ionov v raztopini. Delimo jo na trajno (soli imenovanih kovin: kloridi, sulfati, sulfiti, nitrati), začasno (bikarbonati), ki se izloči z vrenjem. V Rusiji vodo pred uporabo kemično mehčajo za boljšo kakovost.
- Mineralizacija. Lastnost, ki temelji na dipolnem momentu vodikovega oksida. Zahvaljujoč njegovi prisotnosti lahko molekule nase pritrdijo številne druge snovi, ione in jih zadržijo. Tako nastajajo pridruženi, klatrati in druga združenja.
- Redoks lastnosti. Kot univerzalno topilo, katalizator in sodelavec je voda sposobna interakcije s številnimi preprostimi in kompleksnimi spojinami. Pri nekaterih deluje kot oksidant, pri drugih - obratno. Kot reducent reagira s halogeni, solmi, nekaterimi manj aktivnimi kovinami in z mnogimi organskimi snovmi. Organska kemija preučuje najnovejše transformacije. Voda in njene lastnosti, zlasti kemične, kažejo, kako univerzalna in edinstvena je. Kot oksidant reagira z aktivnimi kovinami, nekaterimi binarnimi solmi, številnimi organskimi spojinami, ogljikom in metanom. Na splošno kemijske reakcije, ki vključujejo določeno snov, zahtevajo izbiro določenih pogojev. Od njih bo odvisen rezultat reakcije.
- Biokemijske lastnosti. Voda je sestavni del vseh biokemičnih procesov v telesu, saj je topilo, katalizator in medij.
- Interakcija s plini za tvorbo klatratov. Navadna tekoča voda lahko absorbira tudi kemično neaktivne pline in jih postavi v votline med molekulami notranje strukture. Take spojine običajno imenujemo klatrati.
- Z mnogimi kovinami vodikov oksid tvori kristalne hidrate, v katere je vključen nespremenjen. Na primer bakrov sulfat (CuSO 4 * 5H 2 O), pa tudi navadni hidrati (NaOH * H 2 O in drugi).
- Za vodo so značilne reakcije spojin, pri katerih nastajajo novi razredi snovi (kisline, alkalije, baze). Niso redoks.
- elektroliza. Pod vplivom električnega toka se molekula razgradi na sestavne pline - vodik in kisik. Eden od načinov njihovega pridobivanja je v laboratoriju in industriji.
Z vidika Lewisove teorije je voda šibka kislina in šibka baza hkrati (amfolit). To pomeni, da lahko govorimo o določeni amfoternosti kemijskih lastnosti.

Voda in njene koristne lastnosti za živa bitja
Težko je preceniti pomen, ki ga ima vodikov oksid za vsa živa bitja. Navsezadnje je voda sam vir življenja. Znano je, da brez njega človek ne bi mogel živeti niti enega tedna. Voda, njene lastnosti in pomen so preprosto ogromni.
- Je univerzalno topilo, to je sposobno raztapljanja tako organskih kot anorganskih spojin, ki delujejo v živih sistemih. Zato je voda vir in medij za vse katalitične biokemične transformacije, pri čemer nastajajo kompleksne vitalne kompleksne spojine.
- Sposobnost tvorbe vodikovih vezi naredi to snov univerzalno pri prenašanju temperatur, ne da bi spremenila agregatno stanje. Če temu ne bi bilo tako, bi se ob najmanjšem znižanju stopinj v živih bitjih spremenil v led, kar bi povzročilo celično smrt.
- Za človeka je voda vir vseh osnovnih gospodinjskih dobrin in potreb: kuhanje, pranje, čiščenje, kopanje, kopanje in plavanje itd.
- Industrijski obrati (kemični, tekstilni, inženirski, prehrambeni, rafinerije nafte in drugi) ne bi mogli opravljati svojega dela brez sodelovanja vodikovega oksida.
- Že od antičnih časov so verjeli, da je voda vir zdravja. Uporabljali so ga in ga še danes uporabljajo kot zdravilno snov.
- Rastline ga uporabljajo kot glavni vir prehrane, zaradi česar proizvajajo kisik, plin, ki omogoča življenje na našem planetu.
Naštejemo lahko še na desetine razlogov, zakaj je voda najbolj razširjena, pomembna in potrebna snov za vsa živa in umetno ustvarjena bitja. Navedli smo le najbolj očitne, glavne.

Hidrološki cikel vode
Z drugimi besedami, to je njegov cikel v naravi. Zelo pomemben proces, ki nam omogoča nenehno dopolnjevanje pojemajočih zalog vode. Kako se zgodi?
Glavni udeleženci so trije: podzemna (ali podtalnica) voda, površinska voda in Svetovni ocean. Pomembna je tudi atmosfera, ki kondenzira in proizvaja padavine. Aktivni udeleženci v procesu so tudi rastline (predvsem drevesa), ki lahko absorbirajo ogromne količine vode na dan.
Torej, postopek poteka takole. Podzemna voda polni podzemne kapilare in teče na površje in v Svetovni ocean. Površinsko vodo nato absorbirajo rastline in transpirajo v okolje. Izhlapevanje poteka tudi iz velikih območij oceanov, morij, rek, jezer in drugih vodnih teles. Kaj počne voda, ko je enkrat v ozračju? Kondenzira in teče nazaj v obliki padavin (dež, sneg, toča).
Če teh procesov ne bi bilo, bi zalog vode, predvsem sladke, že zdavnaj zmanjkalo. Zato ljudje posvečajo veliko pozornost zaščiti in normalnemu hidrološkemu ciklu.
Koncept težke vode
V naravi vodikov oksid obstaja kot mešanica izotopologov. To je posledica dejstva, da vodik tvori tri vrste izotopov: protij 1 H, devterij 2 H, tritij 3 H. Kisik pa tudi ne zaostaja in tvori tri stabilne oblike: 16 O, 17 O, 18 O Zato ne obstaja le navadna protijeva voda sestave H 2 O (1 H in 16 O), ampak tudi devterij in tritij.

Hkrati je strukturno in oblikovno stabilen devterij (2H), ki je vključen v sestavo skoraj vseh naravnih voda, vendar v majhnih količinah. Temu pravijo težko. V vseh pogledih je nekoliko drugačen od običajnega ali lahkega.
Za težko vodo in njene lastnosti je značilno več točk.
- Kristalizira pri temperaturi 3,82 0 C.
- Vretje opazimo pri 101,42 0 C.
- Gostota je 1,1059 g/cm3.
- Kot topilo je nekajkrat slabše od lahke vode.
- Ima kemijsko formulo D2O.
Pri izvajanju poskusov, ki dokazujejo vpliv takšne vode na žive sisteme, je bilo ugotovljeno, da so le nekatere vrste bakterij sposobne živeti v njej. Potreboval je čas, da so se kolonije prilagodile in aklimatizirale. Toda, ko so se prilagodili, so popolnoma obnovili vse vitalne funkcije (razmnoževanje, prehrana). Poleg tega je jeklo zelo odporno na sevanje. Poskusi na žabah in ribah niso dali pozitivnega rezultata.
Sodobna področja uporabe devterija in iz njega nastale težke vode sta jedrska in jedrska energija. Takšno vodo lahko dobimo v laboratorijskih pogojih z navadno elektrolizo – nastane kot stranski produkt. Sam devterij nastane med ponavljajočimi se destilacijami vodika v posebnih napravah. Njegova uporaba temelji na njegovi sposobnosti upočasnjevanja nevtronskih fuzij in protonskih reakcij. Težka voda in izotopi vodika so osnova za ustvarjanje jedrske in vodikove bombe.
Poskusi o uporabi devterijeve vode pri ljudeh v majhnih količinah so pokazali, da se ne zadržuje dolgo - popoln umik opazimo po dveh tednih. Ni ga mogoče uporabiti kot vir vlage za življenje, vendar je njegov tehnični pomen preprosto ogromen.
Talilna voda in njena uporaba
Že od antičnih časov so ljudje lastnosti takšne vode prepoznavali kot zdravilne. Že dolgo je bilo opaženo, da ko se sneg topi, živali poskušajo piti vodo iz nastalih luž. Kasneje so natančno proučevali njegovo strukturo in biološke učinke na človeško telo.

Taljena voda, njene značilnosti in lastnosti so v sredini med navadno lahko vodo in ledom. Znotraj ga ne tvorijo le molekule, temveč niz grozdov, ki jih tvorijo kristali in plin. To pomeni, da sta v prazninah med strukturnimi deli kristala vodik in kisik. Na splošno je struktura staljene vode podobna strukturi ledu - struktura se ohrani. Fizikalne lastnosti takšnega vodikovega oksida se nekoliko spremenijo v primerjavi s klasičnimi. Je pa biološki učinek na telo odličen.
Ko je voda zamrznjena, se prva frakcija spremeni v led, težji del - to so izotopi devterija, soli in nečistoče. Zato je treba to jedro odstraniti. Ostalo pa je čista, strukturirana in zdrava voda. Kakšen je učinek na telo? Znanstveniki z raziskovalnega inštituta Donetsk so poimenovali naslednje vrste izboljšav:
- Pospešitev procesov okrevanja.
- Krepitev imunskega sistema.
- Pri otrocih se po vdihavanju te vode obnovijo in pozdravijo prehladi, izginejo kašelj, izcedek iz nosu itd.
- Izboljša se dihanje, stanje grla in sluznice.
- Splošno počutje osebe in aktivnost se povečata.
Danes obstaja veliko podpornikov zdravljenja s talilno vodo, ki pišejo svoje pozitivne ocene. Vendar pa obstajajo znanstveniki, vključno z zdravniki, ki ne podpirajo teh stališč. Menijo, da od takšne vode ne bo škode, koristi pa je tudi malo.
Energija
Zakaj se lahko lastnosti vode pri prehodu v različna agregatna stanja spremenijo in obnovijo? Odgovor na to vprašanje je naslednji: ta spojina ima lasten informacijski pomnilnik, ki beleži vse spremembe in vodi do obnove strukture in lastnosti ob pravem času. Bioenergetsko polje, skozi katerega prehaja del vode (tiste, ki prihaja iz vesolja), nosi močan naboj energije. Ta vzorec se pogosto uporablja pri zdravljenju. Z medicinskega vidika pa vsaka voda ne more imeti blagodejnega učinka, tudi informativnega.
Strukturirana voda - kaj je to?
To je voda, ki ima nekoliko drugačno strukturo molekul, razporeditev kristalnih mrež (enako, kot jo opazimo pri ledu), vendar je še vedno tekočina (v to vrsto spada tudi talina). V tem primeru se sestava vode in njene lastnosti z znanstvenega vidika ne razlikujejo od tistih, ki so značilne za navaden vodikov oksid. Zato strukturirana voda ne more imeti tako širokega zdravilnega učinka, kot ji ga pripisujejo ezoteriki in privrženci alternativne medicine.
Glavna snov, ki omogoča obstoj življenja na planetu, je voda. V vsakem stanju je potrebno. Preučevanje lastnosti tekočin je pripeljalo do oblikovanja celotne znanosti - hidrologije. Predmet proučevanja večine znanstvenikov je fizikalne in kemijske lastnosti. Pod temi lastnostmi razumejo: kritične temperature, kristalno mrežo, nečistoče in druge posamezne značilnosti kemične spojine.
V stiku z
Študij
Vodna formula pozna vsak šolar. To so trije preprosti znaki, ki pa jih vsebuje 75% celotne mase vsega na planetu.
H2O- to sta dva atoma in en - . Struktura molekule ima empirično obliko, zato so lastnosti tekočine kljub enostavni sestavi tako raznolike. Vsaka od molekul je obdana s sosedami. Povezani so z eno kristalno mrežo.
Enostavnost strukture omogoča, da tekočina obstaja v več agregatnih stanjih. Nobena snov na planetu se ne more pohvaliti s tem. H2O je zelo mobilen; po tej lastnosti je takoj za zrakom. Vsi se zavedajo kroženja vode, da potem, ko ta izhlapi s površja zemlje, nekje daleč pade dež ali sneg. Klimatizirano prav zaradi lastnosti tekočine, ki lahko oddaja toploto, sama pa praktično ne spreminja svoje temperature.
Fizične lastnosti
H2O in njene lastnosti odvisno od številnih ključnih dejavnikov. Glavni:
- Kristalna celica. Struktura vode oziroma njena kristalna mreža je določena z njenim agregatnim stanjem. Ima ohlapno, a zelo močno strukturo. Snežinke kažejo mrežo v trdnem stanju, v običajnem tekočem stanju pa voda nima jasne kristalne strukture, so mobilne in spremenljive.
- Struktura molekule je krogla. Toda vpliv gravitacije povzroči, da voda zavzame obliko posode, v kateri se nahaja. V prostoru bo geometrijsko pravilne oblike.
- Voda reagira z drugimi snovmi, vključno s tistimi, ki imajo nedeljene elektronske pare, vključno z alkoholom in amoniakom.
- Ima visoko toplotno zmogljivost in toplotno prevodnost, se hitro segreje in se dolgo ne ohladi.
- Že iz šole je znano, da je vrelišče 100 stopinj Celzija. Ko ta pade na +4 stopinje, se v tekočini pojavijo kristali, pri še večjem znižanju pa nastane led. Vrelišče je odvisno od tlaka, pod katerega je H2O. Obstaja poskus, pri katerem temperatura kemične spojine doseže 300 stopinj, tekočina pa ne vre, ampak tali svinec.
- Druga pomembna lastnost je površinska napetost. Vodna formula mu omogoča, da je zelo obstojen. Znanstveniki so ugotovili, da bo za njegovo zlom potrebna sila z maso več kot 100 ton.
zanimivo! H2O, očiščena nečistoč (destilirana), ne more prevajati toka. Ta lastnost vodikovega oksida se pojavi samo v prisotnosti soli, raztopljenih v njem.
Druge funkcije
Led je edinstveno stanje, ki je značilen za vodikov oksid. Tvori ohlapne vezi, ki se zlahka deformirajo. Poleg tega se razdalja med delci znatno poveča, zaradi česar je gostota ledu veliko manjša od gostote tekočine. To omogoča, da rezervoarji pozimi popolnoma ne zamrznejo, kar ohranja življenje pod plastjo ledu. Ledeniki so velika zaloga sladke vode.
zanimivo! H2O ima edinstveno stanje, imenovano pojav trojne točke. Takrat je v treh svojih stanjih hkrati. Ta pogoj je možen le pri temperaturi 0,01 stopinje in tlaku 610 Pa.
Kemijske lastnosti
Osnovne kemijske lastnosti:
- Vodo delimo po trdoti na mehko in srednje trdo. Ta indikator je odvisen od vsebnosti magnezijevih in kalijevih soli v raztopini. Obstajajo tudi takšni, ki so stalno v tekočini, nekaterih pa se lahko znebimo s prekuhavanjem.
- Oksidacija in redukcija. H2O vpliva na procese, ki jih preučuje kemija in se pojavljajo z drugimi snovmi: nekatere raztopi in z drugimi reagira. Rezultat vsakega poskusa je odvisen od pravilne izbire pogojev, pod katerimi poteka.
- Vpliv na biokemične procese. voda glavni del katere koli celice, v njem, kot v okolju, potekajo vse reakcije v telesu.
- V tekočem stanju absorbira pline, ki so neaktivni. Njihove molekule se nahajajo med molekulami H2O znotraj votlin. Tako nastanejo klatrati.
- S pomočjo vodikovega oksida nastajajo nove snovi, ki niso povezane z redoks procesom. Govorimo o alkalijah, kislinah in bazah.
- Druga značilnost vode je njena sposobnost tvorbe kristalnih hidratov. Vodikov oksid ostane nespremenjen. Med običajnimi hidrati je mogoče razlikovati bakrov sulfat.
- Če skozi priključek teče električni tok, potem molekula se lahko razgradi v pline.

Pomen za osebo
Že zelo dolgo nazaj so ljudje spoznali neprecenljiv pomen tekočine za vsa živa bitja in planet kot celoto. . Brez nje človek ne more živeti in tedne . Kakšen je blagodejni učinek te najpogostejše snovi na Zemlji?
- Najpomembnejša uporaba je njegova prisotnost v telesu, v celicah, kjer potekajo vse najpomembnejše reakcije.
- Tvorba vodikovih vezi blagodejno vpliva na živa bitja, saj ob spremembi temperature tekočina v telesu ne zmrzne.
- Ljudje že dolgo uporabljajo H2O za vsakdanje potrebe, poleg kuhanja, kot so pranje, čiščenje, kopanje.
- Noben industrijski obrat ne more delovati brez tekočine.
- H2O – vir življenja in zdravja, ona je zdravilo.
- Rastline ga uporabljajo v vseh fazah svojega razvoja in življenja. Z njegovo pomočjo proizvajajo kisik, plin, tako potreben za življenje živih bitij.
Poleg najočitnejših koristnih lastnosti jih je še veliko več.

Pomen vode za človeka
Kritična temperatura
H2O ima, tako kot vse snovi, temperaturo, ki imenovano kritično. Kritična temperatura vode je določena z načinom segrevanja. Do 374 stopinj Celzija se tekočina imenuje para; pri določenem tlaku se lahko še vedno spremeni v običajno tekoče stanje. Ko je temperatura nad to kritično točko, se voda kot kemični element nepreklicno spremeni v plin.
Uporaba v kemiji
H2O je zelo zanimiv za kemike zaradi svoje glavne lastnosti - sposobnosti raztapljanja. Znanstveniki ga pogosto uporabljajo za čiščenje snovi in s tem ustvarjajo ugodne pogoje za izvajanje poskusov. V mnogih primerih zagotavlja okolje, v katerem se lahko izvede pilotno testiranje. Poleg tega H2O sama sodeluje v kemičnih procesih in vpliva na en ali drug kemični poskus. Kombinira se z nekovinskimi in kovinskimi snovmi.
Tri države
 Voda se ljudem prikaže v tri države, imenovani agregati. To so tekočina, led in plin. Snov je po sestavi enaka, po lastnostih pa drugačna. U
Voda se ljudem prikaže v tri države, imenovani agregati. To so tekočina, led in plin. Snov je po sestavi enaka, po lastnostih pa drugačna. U
Sposobnost reinkarnacije je zelo pomembna lastnost vode za ves planet, zato se pojavi njeno kroženje.
Če primerjamo vsa tri stanja, človek pogosteje vidi kemično spojino v tekoči obliki. Voda je brez okusa in vonja, kar čutimo v njej, pa je posledica prisotnosti v njej raztopljenih nečistoč, snovi.
Glavne lastnosti vode v tekočem stanju so: ogromna moč, ki vam omogoča brušenje kamnov in uničevanje skal, pa tudi sposobnost sprejemanja kakršne koli oblike.
Ko majhni delci zamrznejo, zmanjšajo svojo hitrost in povečajo razdaljo, tako struktura ledu je porozna in manjše gostote kot tekočina. Led se uporablja v hladilnih napravah za različne gospodinjske in industrijske namene. V naravi led povzroča le razdejanje, pada v obliki toče ali plazu.
Plin je drugo stanje, ki nastane, ko kritična temperatura vode ni dosežena. Običajno pri temperaturah nad 100 stopinj ali izhlapi s površine. V naravi so to oblaki, megle in hlapi. Umetno nastajanje plinov je imelo pomembno vlogo pri tehnološkem napredku v 19. stoletju, ko so izumili parne stroje.
Količina snovi v naravi
75% - takšna številka se bo zdela ogromna, vendar je to vsa voda na planetu, tudi tista, ki je v različnih agregatnih stanjih, v živih bitjih in organskih spojinah. Če upoštevamo samo tekočino, to je vodo, ki jo najdemo v morjih in oceanih, pa tudi trdno vodo - v ledenikih, potem odstotek postane 70,8%.
Odstotna porazdelitev nekaj podobnega:
- morja in oceani – 74,8 %
- H2O iz svežih virov, ki je neenakomerno porazdeljen po planetu, je 3,4 % v ledenikih in le 1,1 % v jezerih, močvirjih in rekah.
- Podzemni viri predstavljajo približno 20,7 % vseh.
Značilnosti težke vode
Pojavi se naravna snov – vodik kot trije izotopi, tudi kisik obstaja v enakem številu oblik. Tako lahko poleg običajne pitne vode izoliramo še devterij in tritij.
Devterij ima najbolj stabilno obliko, najdemo ga v vseh naravnih virih, vendar v zelo majhnih količinah. Tekočina s to formulo ima številne razlike od preproste in lahke. Tako se tvorba kristalov v njem začne že pri temperaturi 3,82 stopinje. Toda vrelišče je nekoliko višje - 101,42 stopinje Celzija. Ima večjo gostoto in sposobnost raztapljanja snovi je bistveno zmanjšana. Označen je tudi z drugo formulo (D2O).
Živi sistemi reagirajo slabo za takšno kemično spojino. Življenju v njem so se lahko prilagodile le nekatere vrste bakterij. Riba takšnega poskusa sploh ni preživela. V človeškem telesu lahko devterij ostane več tednov, nato pa se izloči brez povzročanja škode.
Pomembno! Pitje devterijeve vode je prepovedano!
Edinstvene lastnosti vode. - Samo.
Zaključek
Težka voda se pogosto uporablja v jedrski in jedrski industriji, navadna voda pa se pogosto uporablja po vsem svetu.
vodik.
Vodik je lahek plin brez barve in vonja. Molekula vodika je sestavljena iz dveh atomov, povezanih s kovalentno nepolarno vezjo.
| Prejem: 1. V industriji: Metoda pretvorbe. Prvič, vodni plin dobimo s prehajanjem vodne pare skozi vroč koks pri 1000 °C: C + H 2 O -tà CO + H 2. Nato se ogljikov monoksid (II) oksidira v ogljikov monoksid (IV) s prehodom mešanice vodnega plina s presežno vodno paro preko katalizatorja Fe 2 O 3, segretega na 400–450 ° C: CO + H 2 O = CO 2 + H 2. Oksidacija metana z vodno paro: CH 4 + 2H 2 O –(t, Ni)à4H 2 + CO 2 Termična razgradnja metana pri 1200 °C: CH 4 -tà C + 2H 2 Elektroliza vodne raztopine kuhinjske soli oz. natrijev hidroksid: (NaOH) + 2H 2 O – električni tok 2H 2 + O 2 2NaCl + 2H 2 O – električni tok H 2 + Cl 2 + 2NaOH; 2. V laboratoriju: Zn + 2HCl à ZnCl 2 + H 2 2Al + 2NaOH + 6H 2 O = 2Na + 3H 2 ; Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2. | Lastnosti: 1. S kovinami: H 2 + 2Na -tà2NaH H 2 + Ca -tà CaH 2 2. Z nekovinami: 2H 2 + O 2 à 2H 2 O H 2 + Cl 2 -hvà 2HCl 3H 2 + N 2 -t, p , cat.à 2NH 3 H 2 + S à H 2 S 3. Z oksidi kovin (neaktivni) in nekovin: CuO + H 2 à Cu + H 2 O 2NO + 2H 2 = N 2 + 2H 2 O . |
Vodikove spojine kovin in nekovin.
1. Ionski hidridi: Priprava: H 2 + 2Na -tà2NaH
Lastnosti: razpade z vodo in kislinami:
NaH + H 2 O do NaOH + H 2
CaH 2 + 2HCl à CaCl 2 + 2H 2
2. Kovalentne vodikove spojine:
Vsi plini razen vode (vodikove vezi).
Nestabilen: fosfin in silan.
Njegove glavne lastnosti so: amoniak.
Amfoterične lastnosti izkazujejo: voda.
V vodni raztopini nastanejo kisline: vodikov sulfid in vodikovi halogenidi.
voda
Molekule vode so povezane z vodikovimi vezmi: nH 2 O = (H 2 O) n, zato je voda tekoča, za razliko od svojih plinastih analogov H 2 S, H 2 Se in H 2 Te.
Lastnosti:
1. S kovinami:
a) alkalijske in zemeljskoalkalijske (razen berilija in magnezija): 2Na + 2H 2 O = 2NaOH + H 2
b) preostale kovine v nizu aktivnosti do H lahko oksidiramo z vodno paro v oksid pri visokih temperaturah: Fe + 4H 2 O-tà Fe 3 O 4 + 4H 2
2. Z oksidi alkalijskih in zemeljskoalkalijskih kovin: H 2 O + CaO = Ca (OH) 2
3. S kislimi oksidi topnih kislin: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
4. Hidroliza soli, binarnih spojin kovin in nekovin:
2CuSO 4 + 2H 2 O ⇄ (CuOH) 2 SO 4 + H 2 SO 4
Al 2 S 3 + 6H 2 O à 2Al(OH) 3 + 3H 2 S
Ca 3 P 2 + 6H 2 O à 3Ca(OH) 2 + 2РН 3
PCl 5 + 4H 2 O do H 3 PO 4 + 5HCl
Uporaba vodika
Uporaba vodika temelji na njegovih fizikalnih in kemijskih lastnostih:
- kot lahek plin se uporablja za polnjenje balonov (mešan s helijem);
- kisik-vodikov plamen se uporablja za doseganje visokih temperatur pri varjenju kovin;
- kot reducent se uporablja za pridobivanje kovin (molibden, volfram itd.) iz njihovih oksidov;
- za proizvodnjo amoniaka in umetnega tekočega goriva, za hidrogeniranje maščob.
Elementi skupine IVA.

Ogljik.
1. Preprosta snov. Ima več alotropskih modifikacij: diamant, grafit, karbin, fuleren.
Diamant– kristalna snov, prozorna, močno lomi svetlobne žarke, zelo trda, ne prevaja električnega toka, slabo prevaja toploto. Vsak ogljikov atom je v stanju sp 3 hibridizacije.
Grafit– mehka siva snov s šibkim kovinskim leskom, mastna na dotik, prevaja električni tok. Ogljikovi atomi so v stanju sp2 hibridizacije in so vezani v ravne plasti, sestavljene iz šesterokotnikov, povezanih z robovi, kot v satju.
Grafit je najbolj stabilna alotropna modifikacija ogljika pri sobni temperaturi.
Carbin– drobnokristaliničen siv prah, polprevodnik. Njegovi kristali so sestavljeni iz linearnih verig ogljikovih atomov, povezanih z izmeničnimi trojnimi in enojnimi ali dvojnimi vezmi, ogljik je v stanju sp-hibridizacije: -С≡С-С≡С-С≡С-С≡С-
Carbyne je boljši od grafita v trdoti, vendar je bistveno slabši od diamanta.
fuleren - umetno pridobljena modifikacija ogljika, sestavljena iz molekul C 60, C 70, .... C 1020. Te molekule so sestavljene iz ogljikovih atomov, razporejenih v peterokotnike in šesterokotnike s skupnimi robovi. To so črne snovi s kovinskim leskom, ki imajo polprevodniške lastnosti. Pri tlaku reda 2·10 5 atm in sobni temperaturi se fuleren spremeni v diamant.
Lastnosti ogljika:
| Interakcija s fluorom: ogljik ima nizko reaktivnost, reagira samo s fluorom. | C + 2F 2 = CF 4. |
| Medsebojno delovanje s kisikom: | 2C + O 2 (nezadostno) = 2CO (ogljikov monoksid), C + O 2 (presežek) = CO 2 (ogljikov dioksid). |
| Medsebojno delovanje z drugimi nekovinami: ne deluje z dušikom in fosforjem. | C + 2S = CS 2 C + 2H 2 –t, Nià CH 4 Ca + 2C = CaC 2 3C + 4Al = Al 4 C 3 |
| Interakcija z vodo: pri prehajanju vodne pare skozi vroč premog nastaneta ogljikov monoksid (II) in vodik: | C + H 2 O = CO + H 2. |
| Redukcijske lastnosti: ogljik lahko reducira številne kovine iz njihovih oksidov: | 2ZnO + C –tà 2Zn + CO 4C + Fe 3 O 4 –tà 3Fe + 4CO |
| Koncentrirana žveplova in dušikova kislina pri segrevanju oksidirata ogljik v ogljikov monoksid (IV): | C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O; C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O. |
Karbidi - to so spojine ogljika s kovinami.
Ogljikovi oksidi.
| CO | CO2 | |
| Značilno | ogljikov monoksid – b\c, b\z, strupeno | ogljikov dioksid - b/c, b/z |
| Molekula ogljikovega monoksida (II) ima linearno strukturo. Med atomoma ogljika in kisika nastane trojna vez. | Molekula CO 2 je linearna, vrsta hibridizacije ogljika je sp 2 | |
| Vrsta oksida | ne tvorijo soli | kislina |
| CO + NaOH = HCOONa (natrijev format) 2CO + O 2 = 2CO 2 CO + H 2 = C + H 2 O CO + Cl 2 = COCl 2 (fosgen) CO + CuO = Cu + CO 2 | C + CO 2 = 2CO. 2Mg + CO 2 = 2MgO + C. Tipičen kisli oksid. Na 2 O + CO 2 = Na 2 CO 3, 2NaOH + CO 2 = Na 2 CO 3 + H 2 O, NaOH + CO 2 = NaHCO 3. Kvalitativna reakcija za ugotavljanje ogljikovega dioksida je motnost apnene vode: Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O. | |
| potrdilo o prejemu | 1) Nastane v plinskih generatorjih pri prehodu zraka skozi vroč premog: C + O 2 = CO 2, CO 2 + C = 2CO. 2) Pridobljeno s termično razgradnjo mravljične ali oksalne kisline v prisotnosti koncentrirane žveplove kisline: HCOOH = H 2 O + CO, H 2 C 2 O 4 = CO + CO 2 + H 2 O | Ogljikov dioksid dobimo z žganjem apnenca: CaCO 3 = CaO + CO 2 ali z delovanjem močnih kislin na karbonate in bikarbonate: CaCO 3 +2HCl = CaCl 2 +H 2 O + CO 2, NaHCO 3 + HCl = NaCl + H 2 O + CO 2. |

Ogljikova kislina H 2 CO 3
Ko se ogljikov dioksid raztopi v vodi, nastane zelo šibek ogljikova kislina H 2 CO 3.
Ogljikov dioksid je v vodi predvsem v obliki hidratirane molekule CO 2 in le v majhni meri v obliki ogljikove kisline. V tem primeru se v raztopini vzpostavi ravnovesje:
CO 2 (g) + H 2 O ⇄ CO 2 H 2 O (raztopina) ⇄ H 2 CO 3 ⇄ H + + HCO 3 -
Ogljikova kislina je šibka, nestabilna kislina, ki je ni mogoče izolirati iz vodnih raztopin v prostem stanju.

Karbonati.
1) Kovinski karbonati ( razen alkalnih) pri segrevanju razpadejo:
CuCO3 – tà CuO + CO 2
2) Pri prehodu ogljikovega dioksida iz karbonatov nastanejo hidrokarbonati:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2.
3) Hidrokarbonati razpadejo na karbonate: 2NaHCO 3 – tà Na 2 CO 3 + H 2 O + CO 2 .
4) Karbonati in bikarbonati vstopajo v reakcije izmenjave:
a) z močnimi kislinami (kvalitativna reakcija na karbonate):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
b) s topnimi solmi in bazami, če nastane oborina:
Na 2 CO 3 + Ba(OH) 2 = BaCO 3 ↓+ 2NaOH
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓+ 2NaCl
5) Hidrokarbonati reagirajo z alkalijami in tvorijo srednje soli:
KNSO 3 + KOH = K 2 CO 3 + H 2 O
Silicij.
| Nahaja se v skupini IV periodnega sistema. V zunanji plasti so 4 elektroni, ki imajo elektronsko konfiguracijo 3s 2 3p 2. Prikazuje oksidacijska stanja -4, +2, +4. | Drugi najpogostejši element na Zemlji za kisikom. Najdemo ga samo v obliki spojin. Najpomembnejša spojina silicija- SiO 2 oksid tvori veliko količino naravnih snovi - kamniti kristal, kremen, silicijev dioksid. SiO 2 je nujen za življenje rastlin in živali. Daje moč steblom rastlin in zaščitnim ovojom živali. Po njegovi zaslugi trstičje, trstičje in preslica stojijo močni kot bajoneti, ostri šaševi listi režejo kot noži, strnišče na pokošeni njivi bode kot iglice, stebla žit pa so tako močna, da ne dovolijo njivam na njivah. ležati pred dežjem in vetrom. Ribje luske, lupine žuželk, metuljeva krila, ptičje perje in živalsko krzno so trpežni, ker vsebujejo kremen. |
Fizične lastnosti. Snov je temno sive barve s kovinskim leskom, precej krhka. Tališče 1415 °C, gostota 2,33 g/cm3. Polprevodnik. Za razliko od kovin se njegova električna prevodnost povečuje z naraščajočo temperaturo. Sončne plošče so nameščene na satelitih, vesoljskih plovilih in postajah, ki pretvarjajo sončno energijo v električno. Uporabljajo polprevodniške kristale, predvsem silicij.
Silicijeve sončne celice lahko pretvorijo do 10 % absorbirane sončne energije v električno energijo.
Kemijske lastnosti:
Silicij je tipična nekovina, lahko je oksidant in reducent.
| Interakcija s halogeni: neposredno sodeluje samo s fluorom. Pri segrevanju reagira s klorom. | Si + 2F 2 = SiF 4 Si + 2Cl 2 -tà SiCl 4 |
| Interakcija s kisikom | Si + O 2 -tàSiO 2 |
| Interakcija z drugimi nekovinami: Ne interagira z vodikom. | Si + C -tàSiC 3Si + 2N 2 = Si 3 N 4 |
| Interakcija z vodikovimi halidi. Reagira z vodikovim fluoridom pri normalnih pogojih, s klorovodikovim - pri 300 ° C, z vodikovim bromidom - pri 500 ° C. | Si + 4HF = SiF 4 + 2H 2 |
| Medsebojno delovanje s kovinami: tvori silicide. | 2Ca + Si = Ca 2 Si kalcijev silicid Si + 2Mg = Mg 2 Si Silicidi zlahka razpadejo z vodo ali kislinami, pri čemer se sprosti plinasta vodikova spojina silicija - silan: Mg 2 Si + 2H 2 SO 4 = 2MgSO 4 + SiH 4 Za razliko od ogljikovodiki, se silan na zraku spontano vname in zgori, pri čemer nastane silicijev dioksid in voda: SiH 4 + 20 2 = SiO 2 + 2H 2 O Povečano reaktivnost silana v primerjavi z metanom CH 4 je razloženo z dejstvom, da ima silicij večjo atomsko velikost. kot ogljik, zato so kemične vezi -H šibkejše od vezi C-H. |
| Interakcija s kislinami. Odporen na kisline, deluje samo z mešanico fluorovodikove in dušikove kisline. | 3Si + 4HNO3 + 18HF = 3H2 + 4NO + 8H2O |
| Raztaplja se v alkalijah, tvori silikat in vodik: | Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2 |
Pridobivanje silicija.
Silicidi – spojine silicija s kovinami, v katerih ima silicij oksidacijsko stopnjo -4.
Za silicide alkalijskih in zemeljskoalkalijskih kovin je značilno ionski tip vezi, so kemično aktivni. Z vodo ali razredčenimi kislinami se zlahka razgradijo s sproščanjem silana: Ca 2 Si + 2H 2 SO 4 = 2CaSO 4 + SiH 4.
V nekovinskih silicidih obstaja kovalentna vez. Med takšnimi silicidi je najpomembnejši silicijev karbid - karborund SiC, ki ima strukturo diamanta; odlikujeta ga visoka trdota in tališče ter visoka kemična odpornost.
Silicide pridobivamo s taljenjem enostavnih snovi ali redukcijo mešanice oksidov s koksom v električnih pečeh: 2Mg + Si = Mg 2 Si,
2MgO + SiO 2 + 4C = Mg 2 Si + 4CO.
Silan SiH 4. (monosilan).
Silicijev(IV) oksid– kislinski oksid.
V naravi - rečni pesek, kremen.
Ne reagira z vodo – ker silicijeva kislina je netopna.
2) Pri taljenju reagira z alkalijami: SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
3) Reagira z bazičnimi oksidi: SiO 2 + MgO -tàMgSiO 3 in karbonati alkalijskih kovin: SiO 2 + K 2 CO 3 -tà K 2 SiO 3 + CO 2 med fuzijo.
4) Raztaplja se iz kislin samo v fluorescenčnem: SiO 2 + 6HF = H 2 + 2H 2 O
5) Pri temperaturah nad 1000 ° C reagira z aktivnimi kovinami, kar povzroči nastanek silicija: SiO 2 + 2Mg = Si + 2MgO
ali s presežkom reducenta - silicidi: SiO 2 + 4Mg = Mg 2 Si + 2MgO.
6) Interakcija z nekovinami.
Reagira z vodikom: SiO 2 + 2H 2 = Si + 2H 2 O,
Interakcija z ogljikom: SiO 2 + 3C = SiC + 2CO.
Silicijeva kislina.
Ima polimerno zgradbo in sestavo xSiO 2 yH 2 O. V vodnih raztopinah je dokazan obstoj ortosilicijeve H 4 SiO 4 in metasilicijeve H 2 SiO 3 kisline.

Prejem: le posredno, iz soli: Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
Na 2 SiO 3 + 2H 2 O + 2CO 2 = 2NaHCO 3 + H 2 SiO 3 ↓,
Lastnosti: 1) Raztaplja se v koncentriranih alkalijah: H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
2) Pri segrevanju razpade: H 2 SiO 3 -tàSiO 2 + H 2 O
Silikati.
Večina je netopnih v vodi, razen natrijevih in kalijevih silikatov, ki se imenujejo "tekoče steklo". Njihove vodne raztopine so znano silikatno lepilo.
Prejem: 1) raztapljanje silicija, silicijeve kisline ali oksida v alkalijah:
H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2
SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
2) Fuzija oksidov: CaO + SiO 2 -tà CaSiO 3
3) S fuzijo silicijevega dioksida s karbonatom: SiO 2 + CaC0 3 = CaSiO 3 + C0 2
4) Interakcija soli: K 2 SiO 3 + CaCl 2 = CaSiO 3 + 2KCl
Iz raztopin silikatov z delovanjem nanje močnejših kislin - klorovodikove, žveplove, ocetne in celo ogljikove dobimo silicijevo kislino H 2 SiO 3:
K 2 SiO 3 + 2HCl = 2KSl + H 2 SiO 3
Zato je H 2 SiO 3 zelo šibka kislina. Je netopen v vodi in pade iz reakcijske zmesi v obliki želatinaste oborine, včasih kompaktno zapolni celotno prostornino raztopine in jo spremeni v poltrdno maso, podobno želeju ali želeju. Ko se ta masa posuši, nastane zelo porozna snov - silikagel, ki se pogosto uporablja kot adsorbent - absorber drugih snovi.
Najprej ne pozabite, da so kovine na splošno razdeljene v tri skupine:
1) Reaktivne kovine: Te kovine vključujejo vse alkalijske kovine, zemeljskoalkalijske kovine, pa tudi magnezij in aluminij.
2) Kovine vmesne aktivnosti: te vključujejo kovine, ki se nahajajo med aluminijem in vodikom v nizu aktivnosti.
3) Nizko aktivne kovine: kovine, ki se nahajajo v seriji aktivnosti desno od vodika.
Najprej se morate spomniti, da nizko aktivne kovine (t.j. tiste, ki se nahajajo za vodikom) pod nobenim pogojem ne reagirajo z vodo.
Alkalijske in zemeljskoalkalijske kovine reagirajo z vodo pod kakršnimi koli pogoji (tudi pri običajnih temperaturah in na mrazu), reakcijo pa spremlja sproščanje vodika in tvorba kovinskega hidroksida. Na primer:
2Na + 2H 2 O = 2NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
Magnezij zaradi dejstva, da je prekrit z zaščitno oksidno folijo, reagira z vodo šele, ko je kuhana. Pri segrevanju v vodi se oksidni film, sestavljen iz MgO, uniči in magnezij pod njim začne reagirati z vodo. V tem primeru reakcijo spremlja tudi sproščanje vodika in tvorba kovinskega hidroksida, ki pa je v primeru magnezija netopen:
Mg + 2H 2 O = Mg(OH) 2 ↓ + H 2
Aluminij je tako kot magnezij prekrit z zaščitnim oksidnim filmom, vendar ga v tem primeru z vrenjem ni mogoče uničiti. Za njegovo odstranitev je potrebno mehansko čiščenje (z nekakšnim abrazivom) ali kemično uničenje z alkalijami, raztopinami živosrebrovih soli ali amonijevih soli:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
Srednjeaktivne kovine reagirajo z vodo le, ko je ta v stanju pregrete vodne pare. Samo kovino je treba segreti na vročo temperaturo (približno 600-800 o C). Za razliko od aktivnih kovin kovine z vmesno aktivnostjo reagirajo z vodo in namesto hidroksidov tvorijo kovinske okside. Produkt redukcije je v tem primeru vodik.
OPREDELITEV
voda– vodikov oksid je binarna spojina anorganske narave.
Formula – H 2 O. Molska masa – 18 g/mol. Obstaja lahko v treh agregatnih stanjih - tekočem (voda), trdnem (led) in plinastem (vodna para).
Kemične lastnosti vode
Voda je najpogostejše topilo. V vodni raztopini obstaja ravnotežje, zato se voda imenuje amfolit:
H 2 O ↔ H + + OH — ↔ H 3 O + + OH — .
Pod vplivom električnega toka voda razpade na vodik in kisik:
H 2 O = H 2 + O 2.
Pri sobni temperaturi voda raztopi aktivne kovine, da nastanejo alkalije, sprošča pa se tudi vodik:
2H 2 O + 2Na = 2NaOH + H 2.
Voda je sposobna interakcije s fluorovimi in interhalidnimi spojinami, v drugem primeru pa reakcija poteka pri nizkih temperaturah:
2H 2 O + 2F 2 = 4HF + O 2.
3H 2 O + IF 5 = 5HF + HIO 3.
Soli, ki jih tvorita šibka baza in šibka kislina, se pri raztapljanju v vodi hidrolizirajo:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S.
Voda lahko pri segrevanju raztopi nekatere snovi, kovine in nekovine:
4H 2 O + 3Fe = Fe 3 O 4 + 4H 2;
H 2 O + C ↔ CO + H 2 .
Voda v prisotnosti žveplove kisline vstopi v interakcijske reakcije (hidratacijo) z nenasičenimi ogljikovodiki - alkeni s tvorbo nasičenih monohidričnih alkoholov:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH.
Fizikalne lastnosti vode
Voda je bistra tekočina (n.s.). Dipolni moment je 1,84 D (zaradi velike razlike v elektronegativnostih kisika in vodika). Voda ima največjo specifično toplotno kapaciteto med vsemi snovmi v tekočem in trdnem agregatnem stanju. Specifična talilna toplota vode je 333,25 kJ/kg (0 C), uparjanje 2250 kJ/kg. Voda lahko raztopi polarne snovi. Voda ima visoko površinsko napetost in negativen površinski električni potencial.
Pridobivanje vode
Vodo pridobivamo z reakcijo nevtralizacije, tj. reakcije med kislinami in alkalijami:
H 2 SO 4 + 2KOH = K 2 SO 4 + H 2 O;
HNO 3 + NH 4 OH = NH 4 NO 3 + H 2 O;
2CH 3 COOH + Ba(OH) 2 = (CH 3 COO) 2 Ba + H 2 O.
Eden od načinov pridobivanja vode je redukcija kovin z vodikom iz njihovih oksidov:
CuO + H 2 = Cu + H 2 O.
Primeri reševanja problemov
PRIMER 1
| telovadba | Koliko vode potrebujete za pripravo 5% raztopine iz 20% raztopine ocetne kisline? |
| rešitev | Glede na definicijo masnega deleža snovi je 20% raztopina ocetne kisline 80 ml topila (voda) 20 g kisline, 5% raztopina ocetne kisline pa 95 ml topila (voda) 5 g kisline. . Naredimo razmerje: x = 20 × 95 /5 = 380. Tisti. nova raztopina (5%) vsebuje 380 ml topila. Znano je, da je začetna raztopina vsebovala 80 ml topila. Zato morate za pridobitev 5% raztopine ocetne kisline iz 20% raztopine dodati: 380-80 = 300 ml vode. |
| Odgovori | Potrebujete 300 ml vode. |
PRIMER 2
| telovadba | Pri zgorevanju organske snovi z maso 4,8 g je nastalo 3,36 l ogljikovega dioksida (CO) in 5,4 g vode. Gostota vodika organske snovi je 16. Določite formulo organske snovi. |
| rešitev | Molske mase ogljikovega dioksida in vode, izračunane s pomočjo tabele kemijskih elementov D.I. Mendeleev – 44 oziroma 18 g/mol. Izračunajmo količino snovi v produktih reakcije: n(CO 2) = V(CO 2) / V m; n(H2O) = m(H2O) / M(H2O); n(CO 2) = 3,36 / 22,4 = 0,15 mol; n(H 2 O) = 5,4 / 18 = 0,3 mol. Glede na to, da molekula CO 2 vsebuje en atom ogljika, molekula H 2 O pa vsebuje 2 atoma vodika, bo količina snovi in masa teh atomov enaka: n(C) = 0,15 mol; n(H) = 2×0,3 mol; m(C) = n(C) × M(C) = 0,15 × 12 = 1,8 g; m(N) = n(N) × M(N) = 0,3 × 1 = 0,3 g. Ugotovimo, ali organska snov vsebuje kisik: m(O) = m(C x H y O z) – m(C) – m(H) = 4,8 – 0,6 – 1,8 = 2,4 g. Količina snovi atomov kisika: n(O) = 2,4 / 16 = 0,15 mol. Potem je n(C): n(H): n(O) = 0,15: 0,6: 0,15. Če delimo z najmanjšo vrednostjo, dobimo n(C):n(H): n(O) = 1: 4: 1. Zato je formula organske snovi CH 4 O. Izračunana molska masa organske snovi z uporabo tabele kemijskih elementov D.I. Mendelejev – 32 g/mol. Molska masa organske snovi, izračunana z njeno gostoto vodika: M(C x H y O z) = M(H 2) × D(H 2) = 2 × 16 = 32 g/mol. Če se formule organske snovi, pridobljene iz produktov zgorevanja in z uporabo gostote vodika, razlikujejo, bo razmerje molskih mas večje od 1. Preverimo to: M(C x H y O z) / M(CH 4 O) = 1. Zato je formula organske snovi CH 4 O. |
| Odgovori | Formula organske snovi je CH 4 O. |