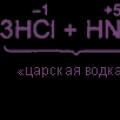Cl 2 ở mức vol. T - khí màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí, ít tan trong nước (~ 6,5 g/l); X. R. trong dung môi hữu cơ không phân cực. Nó chỉ được tìm thấy ở dạng tự do trong khí núi lửa.
Phương pháp thu được
Dựa vào quá trình oxy hóa anion Cl -
2Cl - - 2e - = Cl 2 0
Công nghiệp
Điện phân dung dịch nước clorua, thường là NaCl:
2NaCl + 2H 2 O = Cl 2 + 2NaOH + H 2
Phòng thí nghiệm
Sự oxy hóa của conc. HCI với các tác nhân oxy hóa khác nhau:
4HCI + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
16HCl + 2KMnO 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O
6HCl + KClO 3 = 3Cl 2 + KCl + 3H 2 O
14HCl + K 2 Cr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Tính chất hóa học
Clo là chất oxi hóa rất mạnh. Oxi hóa kim loại, phi kim và các chất phức tạp, chuyển thành anion Cl - rất bền:
Cl 2 0 + 2e - = 2Cl -
Phản ứng với kim loại
Kim loại hoạt động trong môi trường khí clo khô bốc cháy và cháy; trong trường hợp này, clorua kim loại được hình thành.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Các kim loại có hoạt tính thấp dễ bị oxy hóa hơn bởi clo ướt hoặc dung dịch nước của nó:
Cl 2 + Cu = CuCl 2
3Cl 2 + 2Au = 2AuCl 3
Phản ứng với phi kim
Clo không chỉ tương tác trực tiếp với O 2, N 2, C. Phản ứng với các phi kim loại khác xảy ra trong các điều kiện khác nhau.
Các halogenua phi kim được hình thành. Phản ứng quan trọng nhất là tương tác với hydro.
Cl 2 + H 2 = 2HC1
Cl 2 + 2S (tan chảy) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (hoặc РCl 5 - vượt quá Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 = 2ICl 3
Sự dịch chuyển của các phi kim loại tự do (Br 2, I 2, N 2, S) khỏi hợp chất của chúng
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI = I 2 + 2KCl
Cl 2 + 2HI = I 2 + 2HCl
Cl 2 + H 2 S = S + 2HCl
3Cl 2 + 2NH 3 = N 2 + 6HCl
Sự mất cân đối của clo trong nước và dung dịch kiềm
Do hiện tượng tự oxy hóa - tự khử, một số nguyên tử clo bị chuyển hóa thành anion Cl -, trong khi một số nguyên tử khác ở trạng thái oxy hóa dương được đưa vào anion ClO - hoặc ClO 3 -.
Cl 2 + H 2 O = HCl + HClO axit hypoclorơ
Cl 2 + 2KOH = KCl + KClO + H 2 O
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
3Cl 2 + 2Ca(OH) 2 = CaCl 2 + Ca(ClO) 2 + 2H 2 O
Những phản ứng này rất quan trọng vì chúng dẫn đến việc sản xuất các hợp chất oxy clo:
KClO 3 và Ca(ClO) 2 - hypoclorit; KClO 3 - kali clorat (muối Berthollet).
Tương tác của clo với các chất hữu cơ
a) sự thay thế nguyên tử hydro trong phân tử OM
b) sự gắn kết của các phân tử Cl2 tại vị trí đứt gãy của nhiều liên kết cacbon-cacbon
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-dichloroethane
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-tetrachloroethane
Hiđro clorua và axit clohiđric
khí hydro clorua
Các tính chất vật lý và hóa học
HCl - hydro clorua. Tại vòng quay. T - không màu. một loại khí có mùi hăng, hóa lỏng khá dễ dàng (mp -114°C, bp -85°C). HCl khan, ở cả trạng thái khí và lỏng, không dẫn điện và trơ về mặt hóa học đối với kim loại, oxit kim loại và hydroxit, cũng như nhiều chất khác. Điều này có nghĩa là khi không có nước, hydro clorua không thể hiện tính chất axit. Chỉ ở nhiệt độ rất cao, khí HCl mới phản ứng với kim loại, thậm chí cả những kim loại có hoạt tính thấp như Cu và Ag.
Tính chất khử của anion clorua trong HCl cũng xuất hiện ở mức độ nhỏ: nó bị oxy hóa bởi flo ở thể tích. T, và ở nhiệt độ T cao (600°C) với sự có mặt của chất xúc tác, nó phản ứng thuận nghịch với oxy:
2HCl + F2 = Cl2 + 2HF
4HCl + O 2 = 2Сl 2 + 2H 2 O
Khí HCl được sử dụng rộng rãi trong tổng hợp hữu cơ (phản ứng hydroclo hóa).
Phương pháp thu được
1. Tổng hợp từ các chất đơn giản:
H2 + Cl2 = 2HCl
2. Được hình thành như một sản phẩm phụ trong quá trình clo hóa hydrocarbon:
R-H + Cl 2 = R-Cl + HCl
3. Trong phòng thí nghiệm, nó thu được nhờ tác dụng của conc. H 2 SO 4 đối với clorua:
H 2 SO 4 (kết hợp) + NaCl = 2HCl + NaHSO 4 (với nhiệt độ thấp)
H 2 SO 4 (kết luận) + 2NaCl = 2HCl + Na 2 SO 4 (với nhiệt độ rất cao)
Dung dịch nước HCl - axit mạnh (clohydric hoặc hydrochloric)
HCl tan nhiều trong nước: ở thể tích. Trong 1 lít H 2 O ~ 450 lít khí được hòa tan (sự hòa tan đi kèm với việc giải phóng một lượng nhiệt đáng kể). Dung dịch bão hòa có phần khối lượng HCl bằng 36-37%. Dung dịch này có mùi rất hăng, ngột ngạt.
Các phân tử HCl trong nước gần như phân hủy hoàn toàn thành các ion, tức là dung dịch HCl trong nước là một axit mạnh.
Tính chất hóa học của axit clohydric
1. HCl hòa tan trong nước có đầy đủ tính chất chung của axit do có ion H+
HCl → H + + Cl -
Sự tương tác:
a) với kim loại (đến H):
2HCl 2 + Zn = ZnCl 2 + H 2
b) với oxit bazơ và lưỡng tính:
2HCl + CuO = CuCl 2 + H 2 O
6HCl + Al 2 O 3 = 2AlCl 3 + ZN 2 O
c) với bazơ và hydroxit lưỡng tính:
2HCl + Ca(OH) 2 = CaCl 2 + 2H 2 O
3HCl + Al(OH) 3 = AlCl 3 + ZH 2 O
d) với muối của axit yếu hơn:
2HCl + CaCO 3 = CaCl 2 + CO 2 + H 3 O
HCl + C 6 H 5 ONa = C 6 H 5 OH + NaCl
e) với amoniac:
HCl + NH 3 = NH 4 Cl
Phản ứng với các chất oxy hóa mạnh F 2, MnO 2, KMnO 4, KClO 3, K 2 Cr 2 O 7. Anion Cl - bị oxy hóa thành halogen tự do:
2Cl - - 2e - = Cl 2 0
Đối với các phương trình phản ứng, xem "Sản xuất clo." Đặc biệt quan trọng là ORR giữa axit clohydric và axit nitric:

Phản ứng với các hợp chất hữu cơ
Sự tương tác:
a) với các amin (dưới dạng bazơ hữu cơ)
R-NH 2 + HCl → + Cl -
b) với các axit amin (dưới dạng hợp chất lưỡng tính)

Oxit clo và axit oxo
Oxit axit

Axit

muối
Tính chất hóa học
1. Tất cả các axit oxo clo và muối của chúng đều là tác nhân oxy hóa mạnh.
2. Hầu hết tất cả các hợp chất đều bị phân hủy khi đun nóng do quá trình oxy hóa-khử nội phân tử hoặc không cân xứng.

Bột tẩy trắng
Vôi cloric (tẩy trắng) là hỗn hợp của hypochlorite và canxi clorua, có tác dụng tẩy trắng và khử trùng. Đôi khi được coi là một ví dụ về muối hỗn hợp chứa đồng thời anion của hai axit:

nước Javel
Dung dịch nước kali clorua và hapochlorite KCl + KClO + H 2 O
(Clorum; từ tiếng Hy Lạp - màu vàng lục), Cl - hóa chất. nguyên tố nhóm VII của hệ tuần hoàn các nguyên tố; Tại. N. 17, lúc. m.35.453. Khí màu vàng xanh, có mùi hăng. Trong các hợp chất, nó thể hiện các trạng thái oxy hóa - 1, + 1, +3, + 5 và + 7. Các hợp chất ổn định nhất là X. với trạng thái oxy hóa cực đại: - 1 và + 7. X tự nhiên bao gồm các đồng vị 35Cl (75,53%). ) và 37Сl (24,47%). Có bảy đồng vị phóng xạ đã biết với số khối 32-40 và hai đồng phân; đồng vị 36Cl tồn tại lâu nhất với chu kỳ bán rã 3,08 x 10 5 năm (phân rã beta, bắt electron). X. được phát hiện vào năm 1774 bởi nhà hóa học người Thụy Điển K. Scheele và được người Anh cô lập vào năm 1810. nhà hóa học G. Davy.
Hàm lượng clo trong vỏ trái đất là 4,5 x 10-2%. Có ch. Array. trong nước biển (lên đến 2% clorua), ở dạng lắng đọng muối đá NaCl, sylvit, Carnallite, bischofite MgCl2x6H20 và kainite KMg 3H20. Thể chất cơ bản hằng số điểm nóng chảy của nguyên tố X. -101,6° C; điểm sôi - 34,6° C; khối lượng riêng của chất lỏng X. (tại điểm sôi) 1,56 g/cm3; nhiệt nóng chảy 1,62 kcal/mol; nhiệt bay hơi (tại điểm sôi) 4,42 kcal/mol. X. kết hợp trực tiếp với hầu hết các phi kim (trừ cacbon)
Sự phụ thuộc của ứng suất phát sinh và lan truyền vết nứt giòn vào nhiệt độ, đặc trưng cho khả năng chịu lạnh của kết cấu thép theo nhiệt độ tới hạn: 1 - cường độ chảy; 2 - xảy ra sự hủy diệt; h - tuyên truyền hủy diệt; t > t1 - diện tích phá hủy dẻo; t2< t < t1, - область квазихрупких разрушений; t < t2-область хрупких разрушений. да, азота и кислорода)и с подавляющим большинством металлов.
Đôi khi clo phản ứng với kim loại khi có dấu vết của hơi ẩm. Clo khô không tương tác với sắt nên có thể bảo quản được trong các bình thép. Trên nhiệt độ 540° C, không có kim loại nào có khả năng chống lại X. (ở nhiệt độ này, kim loại có khả năng chống lại khí X. cao nhất, các kim loại có hàm lượng niken cao như Inconel, bắt đầu bị ăn mòn). Hòa tan trong nước (2 thể tích trên 1 thể tích nước ở nhiệt độ 25 ° C), thủy phân một phần tạo thành dung dịch axit hypochlorous và axit clohydric. Trong các hợp chất của X. với phi kim, quan trọng nhất là HCl clorua, được hình thành do tương tác trực tiếp (dưới ánh sáng) của Clo với hydro hoặc dưới tác dụng của các khoáng chất, axit mạnh (ví dụ H2SO4) trên kim loại. các hợp chất với clo (ví dụ NaCl), và cũng là sản phẩm phụ khi thu được số nhiều. hợp chất clo hữu cơ. Clorua là chất khí không màu, ở trạng thái khô không tương tác với hầu hết các kim loại và oxit của chúng. Nó hòa tan rất tốt trong nước (426 thể tích HCl trong 1 thể tích nước ở nhiệt độ 25° C), tạo thành axit clohydric.
Axit clohydric, rất mạnh, tương tác với tất cả các kim loại có độ âm điện (đứng trong dãy điện hóa trên hydro). Trong các dung dịch hydro clorua không chứa nước (ví dụ, trong axetonitril), một số chất điện ly (ví dụ, ) cũng có thể bị ăn mòn. Clo không tương tác trực tiếp với oxy. Cl20, ClO2, Cl206 và Cl207 có thể thu được gián tiếp, tương ứng với các axit HClO - hypochlorous (muối - hypochlorite), HClO2 - clorua (muối -), HClO3 - hypochlorous (muối - clorat) và HClO4 - perchloric (muối - perchlorate ). Các hợp chất hypochlorous và clorua không ổn định và chỉ tồn tại trong dung dịch nước loãng. Tất cả clo đều là chất oxi hóa mạnh.
Khả năng oxy hóa của to-t và muối của chúng giảm, độ bền tăng từ hypochlorous sang cloric. Các chất oxy hóa được sử dụng phổ biến nhất là canxi clorit Ca(OCl)2, muối bertholite KClO3 và thuốc tẩy Ca2OCl2 - muối kép của axit clohydric và axit hypochlorous. Clo kết hợp với các halogen khác tạo thành các hợp chất liên halogen: ClF, ClF3, BrCl, IСl và IC3. Theo hóa học Các hợp chất thánh của các nguyên tố có clo () được chia thành muối, clorua axit và trung tính không giống muối. Clorua giống muối bao gồm các hợp chất với clo của kim loại I, II và IIIa thuộc các nhóm nhỏ của hệ tuần hoàn các nguyên tố, cũng như các hợp chất với kim loại X. thuộc các nhóm khác ở trạng thái oxy hóa thấp hơn. Hầu hết các clorua giống muối đều tan chảy ở nhiệt độ cao và hòa tan cao trong nước với một số ngoại lệ (ví dụ: AgCl).
Các chất giống muối ở trạng thái nóng chảy dẫn dòng điện tương đối tốt (độ dẫn điện của chúng ở nhiệt độ 800°C là LiCl - 2,17; NaCl - 3,57; KCl - 2,20 ohm -1 cb -1). Clorua axit bao gồm clorua của các phi kim loại (ví dụ boron, silicon, phốt pho) và clorua của kim loại thuộc phân nhóm IIIb và nhóm IV-VIII của hệ thống tuần hoàn ở trạng thái oxy hóa cao hơn. Axit clorua khi tương tác với nước sẽ tạo thành axit tương ứng và giải phóng clorua. Ví dụ, clorua trung tính không có muối là CCl4 tetraclorua. Nền tảng dạ hội. phương pháp thu được dung dịch X. của NaCl hoặc HCl (cực dương than chì hoặc titan). Clo rất độc, hàm lượng X. tự do tối đa cho phép trong không khí là 0,001 mg/l. Clo là chất quan trọng nhất trong các halogen; nó được sử dụng để tẩy vải và giấy, khử trùng nước uống, sản xuất axit clohydric, trong tổng hợp hữu cơ, sản xuất và tinh chế nhiều kim loại bằng phương pháp luyện kim clo. Hypochlorite cũng được sử dụng làm chất tẩy trắng và khử trùng, trong sản xuất pháo hoa và diêm, và perchlorate được sử dụng như một thành phần của nhiên liệu tên lửa rắn.
Khí clo có màu vàng lục. Nó độc, có mùi sắc, ngột ngạt, khó chịu. Clo nặng hơn không khí, tan tương đối tốt trong nước (đối với 1 thể tích nước, 2 thể tích clo), tạo thành nước clo; Cl 2 aqi biến thành chất lỏng ở nhiệt độ -34 °C và cứng lại ở -101 °C. Mật độ 1,568 g/cm3³
Cl - là một chất được sử dụng trong Chiến tranh thế giới thứ nhất như một tác nhân chiến tranh hóa học, vì nó nặng hơn không khí và được giữ lại tốt trên bề mặt trái đất. Nồng độ clo tự do tối đa cho phép trong không khí là 0,001 mg/l.
Ngộ độc clo mãn tính gây ra những thay đổi về nước da, các bệnh về phổi và phế quản. Trong trường hợp ngộ độc clo, nên sử dụng hỗn hợp hơi rượu với ether hoặc hơi nước trộn với amoniac làm thuốc giải độc.
Với số lượng nhỏ, clo có thể chữa khỏi các bệnh về đường hô hấp trên vì nó có tác dụng bất lợi đối với vi khuẩn. Do tác dụng khử trùng nên clo được dùng để khử trùng nước hydro.
Là muối, chúng là những yếu tố quan trọng. Clo ở dạng muối ăn thường xuyên được sử dụng trong thực phẩm và cũng là một phần của cây xanh - diệp lục.
Sự tương tác của clo với hydro chỉ xảy ra một cách bùng nổ khi có ánh sáng:
Cl 2 + H 2 = 2HCl
2Na + Cl2 = 2NaCl
Đây là cơ sở để tăng tỷ lệ kim loại quý trong hợp kim cấp thấp, để làm được điều này, vật liệu nghiền trước được nung nóng với sự có mặt của clo tự do đi qua.
Nếu kim loại có thể có các trạng thái oxy hóa khác nhau thì khi phản ứng với clo chúng biểu hiện cao nhất:
2Fe + 3Cl2 = 2FeCl3
Cu + Cl2 = CuCl 2
Tương tác của clo với các chất phức tạp
Khi clo tương tác với các chất phức tạp, nó hoạt động giống như khi tương tác với nước chẳng hạn. Lúc đầu, halogen hòa tan trong nước tạo thành nước clo (Claq), sau đó dần dần xảy ra phản ứng giữa nước và clo:
Cl2 + H 2 O = 2HCl + [O]
Tuy nhiên, phản ứng này không tiến hành ngay lập tức để hình thành sản phẩm cuối cùng. Ở giai đoạn đầu tiên của quá trình, hai axit được hình thành - HCl hydrochloric và hypochlorous (hỗn hợp axit này được hòa tan)
Cl 2 + H 2 O = HCl + HClO
Axit hypoclorơ sau đó bị phân hủy:
HClO = HCl + [O]
Sự hình thành nguyên tửoxy giải thích phần lớn tác dụng oxy hóa của clo. Thuốc nhuộm hữu cơ cho vào nước clo sẽ bị đổi màu. Thử nghiệm quỳ tím không thu được màu đặc trưng trong axit mà mất hoàn toàn, điều này được giải thích là do sự có mặt của oxy nguyên tử, chất này có tác dụng oxy hóa quỳ tím.
Halogen cũng phản ứng với các chất hữu cơ
Nếu bạn đưa một mảnh giấy ngâm trong nhựa thông (một chất hữu cơ bao gồm hydro và carbon) vào môi trường clo, bạn sẽ nhận thấy thải ra một lượng lớn bồ hóng và có mùi hydro clorua, đôi khi phản ứng xảy ra dẫn đến cháy. Điều này được giải thích là do clo chuyển khỏi các hợp chất với hydro và tạo thành hydro clorua, đồng thời được giải phóng dưới dạng bồ hóng ở trạng thái tự do. Đây là lý do tại sao các sản phẩm cao su không được sử dụng.
15.1. Đặc điểm chung của halogen và chalcogen
Các halogen (“tạo muối”) là các nguyên tố thuộc nhóm VIIA. Chúng bao gồm flo, clo, brom và iốt. Nhóm này cũng bao gồm astatine không ổn định và do đó không tìm thấy trong tự nhiên. Đôi khi hydro cũng được bao gồm trong nhóm này.
Chalcogens (“sản xuất đồng”) là các thành phần của nhóm VIA. Chúng bao gồm oxy, lưu huỳnh, selen, Tellurium và polonium, những chất thực tế không được tìm thấy trong tự nhiên.
Trong số tám nguyên tử tồn tại trong tự nhiên yếu tố trong hai nhóm này nguyên tử oxy phổ biến nhất ( w= 49,5%), tiếp theo là lượng nguyên tử clo dồi dào ( w= 0,19%), sau đó – lưu huỳnh ( w= 0,048%), sau đó là flo ( w= 0,028%). Nguyên tử của các nguyên tố khác nhỏ hơn hàng trăm, hàng nghìn lần. Bạn đã học oxy ở lớp 8 (Chương 10); trong số các nguyên tố khác, quan trọng nhất là clo và lưu huỳnh - bạn sẽ làm quen với chúng trong chương này.
Bán kính quỹ đạo của các nguyên tử halogen và chalcogen rất nhỏ và chỉ có nguyên tử thứ tư của mỗi nhóm tiếp cận một angstrom. Điều này dẫn đến thực tế là tất cả các nguyên tố này đều là các nguyên tố tạo thành phi kim và chỉ có Tellurium và iốt là có một số dấu hiệu lưỡng tính.
Công thức điện tử hóa trị chung của halogen là ns 2 n.p. 5 và chalcogen – ns 2 n.p. 4 . Kích thước nhỏ của nguyên tử không cho phép chúng nhường electron mà ngược lại, nguyên tử của các nguyên tố này có xu hướng nhận chúng, tạo thành các anion tích điện đơn (đối với halogen) và anion tích điện kép (đối với chalcogen). Bằng cách kết hợp với các nguyên tử nhỏ, nguyên tử của các nguyên tố này tạo thành liên kết cộng hóa trị. Bảy electron hóa trị cho phép các nguyên tử halogen (trừ flo) hình thành tối đa bảy liên kết cộng hóa trị và sáu electron hóa trị của nguyên tử chalcogen - tối đa sáu liên kết cộng hóa trị.
Trong các hợp chất flo, nguyên tố có độ âm điện lớn nhất, chỉ có thể có một trạng thái oxy hóa, đó là –I. Như bạn đã biết, oxy có trạng thái oxy hóa tối đa là +II. Đối với nguyên tử của các nguyên tố khác, trạng thái oxi hóa cao nhất bằng số nhóm.
Các chất đơn giản thuộc các nguyên tố nhóm VIIA có cùng loại về cấu trúc. Chúng bao gồm các phân tử diatomic. Trong điều kiện bình thường, flo và clo là chất khí, brom là chất lỏng và iốt là chất rắn. Theo tính chất hóa học của chúng, các chất này là tác nhân oxy hóa mạnh. Do kích thước của các nguyên tử tăng lên và số nguyên tử tăng lên nên hoạt tính oxy hóa của chúng giảm đi.
Trong số các chất đơn giản thuộc nhóm VIA, trong điều kiện bình thường chỉ có oxy và ozon là ở thể khí, lần lượt bao gồm các phân tử hai nguyên tử và ba nguyên tử; phần còn lại là chất rắn. Lưu huỳnh bao gồm các phân tử tuần hoàn tám nguyên tử S 8, selen và Tellurium từ các phân tử polymer Se N và Tế N. Xét về hoạt tính oxy hóa, chalcogen kém hơn halogen: chỉ oxy là tác nhân oxy hóa mạnh, trong khi các chất còn lại thể hiện đặc tính oxy hóa ở mức độ thấp hơn nhiều.
hợp chất hợp chất hydro halogen (HE) hoàn toàn tuân thủ quy luật chung và chalcogen, ngoài các hợp chất hydro thông thường có thành phần H 2 E, còn có thể tạo thành các hợp chất hydro phức tạp hơn có thành phần H 2 E N cấu trúc chuỗi. Trong dung dịch nước, cả hydro halogenua và hydro chalcogen khác đều thể hiện tính chất axit. Phân tử của chúng là các hạt axit. Trong số này chỉ có HCl, HBr và HI là axit mạnh.
Để hình thành halogen oxit không đặc trưng, hầu hết chúng đều không ổn định, nhưng các oxit cao hơn có thành phần E 2 O 7 được biết đến với tất cả các halogen (ngoại trừ flo, các hợp chất oxy không phải là oxit). Tất cả các oxit halogen đều là các chất phân tử; tính chất hóa học của chúng là các oxit axit.
Tùy theo khả năng hóa trị của chúng, chalcogen tạo thành hai chuỗi oxit: EO 2 và EO 3. Tất cả các oxit này đều có tính axit.
Hydroxit của halogen và chalcogen là oxoaxit.
Lập công thức điện tử viết tắt và giản đồ năng lượng của nguyên tử các nguyên tố nhóm VIA và VIIA. Chỉ ra các electron bên ngoài và hóa trị.
Clo là phổ biến nhất và do đó quan trọng nhất trong các halogen.
Trong vỏ trái đất, clo được tìm thấy trong các khoáng chất: halit (muối đá) NaCl, sylvit KCl, Carnallite KCl MgCl 2 6H 2 O và nhiều loại khác. Phương pháp sản xuất công nghiệp chính là điện phân natri hoặc kali clorua.
Một chất đơn giản, clo, là một chất khí màu xanh lục có mùi hăng, gây ngạt thở. Ở -101 °C nó ngưng tụ thành chất lỏng màu vàng lục. Clo rất độc; trong Thế chiến thứ nhất, người ta thậm chí còn cố gắng sử dụng nó làm tác nhân chiến tranh hóa học.
Clo là một trong những chất oxy hóa mạnh nhất. Nó phản ứng với hầu hết các chất đơn giản (ngoại trừ: khí hiếm, oxy, nitơ, than chì, kim cương và một số chất khác). Kết quả là halogenua được hình thành:
Cl 2 + H 2 = 2HCl (khi đun nóng hoặc tiếp xúc với ánh sáng);
5Cl 2 + 2P = 2PCl 5 (khi đốt cháy dư clo);
Cl 2 + 2Na = 2NaCl (ở nhiệt độ phòng);
3Cl 2 + 2Sb = 2SbCl 3 (ở nhiệt độ phòng);
3Cl 2 + 2Fe = 2FeCl 3 (khi đun nóng).
Ngoài ra, clo còn có thể oxy hóa nhiều chất phức tạp, ví dụ:
Cl 2 + 2HBr = Br 2 + 2HCl (ở pha khí và trong dung dịch);
Cl 2 + 2HI = I 2 + 2HCl (ở pha khí và trong dung dịch);
Cl 2 + H 2 S = 2HCl + S (trong dung dịch);
Cl 2 + 2KBr = Br 2 + 2KCl (trong dung dịch);
Cl 2 + 3H 2 O 2 = 2HCl + 2H 2 O + O 2 (trong dung dịch đậm đặc);
Cl 2 + CO = CCl 2 O (ở pha khí);
Cl 2 + C 2 H 4 = C 2 H 4 Cl 2 (ở pha khí).
Trong nước, clo bị hòa tan một phần (vật lý) và một phần phản ứng thuận nghịch với nó (xem § 11.4 c). Với dung dịch kali hydroxit lạnh (và bất kỳ chất kiềm nào khác), phản ứng tương tự xảy ra không thể thuận nghịch:
Cl 2 + 2OH = Cl + ClO + H 2 O.
Kết quả là tạo thành dung dịch kali clorua và hypochlorite. Khi phản ứng với canxi hydroxit sẽ tạo thành hỗn hợp CaCl 2 và Ca(ClO) 2, gọi là chất tẩy.
Với dung dịch kiềm đậm đặc nóng, phản ứng diễn ra khác nhau:
3Cl 2 + 6OH = 5Cl + ClO 3 + 3H 2 O.
Khi phản ứng với KOH sẽ tạo ra kali clorat, gọi là muối Berthollet.
Hydro clorua là chất duy nhất kết nối hydro clo Khí không màu, có mùi ngột ngạt, hòa tan nhiều trong nước (phản ứng hoàn toàn với nó, tạo thành các ion oxonium và ion clorua (xem § 11.4). Dung dịch của nó trong nước được gọi là axit clohydric hoặc axit clohydric. Đây là một trong những sản phẩm quan trọng nhất của công nghệ hóa học, vì axit clohydric được tiêu thụ trong nhiều ngành công nghiệp. Nó cũng có tầm quan trọng lớn đối với con người, đặc biệt vì nó có trong dịch dạ dày, tạo điều kiện thuận lợi cho quá trình tiêu hóa thức ăn.
Hydro clorua trước đây được sản xuất công nghiệp bằng cách đốt clo trong hydro. Hiện nay, nhu cầu về axit clohydric gần như được đáp ứng hoàn toàn thông qua việc sử dụng hydro clorua, được hình thành như một sản phẩm phụ trong quá trình clo hóa các chất hữu cơ khác nhau, ví dụ như metan:
CH4 + Cl2 = CH 3 + HCl
Và các phòng thí nghiệm sản xuất hydro clorua từ natri clorua bằng cách xử lý nó bằng axit sulfuric đậm đặc:
NaCl + H 2 SO 4 = HCl + NaHSO 4 (ở nhiệt độ phòng);
2NaCl + 2H 2 SO 4 = 2HCl + Na 2 S 2 O 7 + H 2 O (khi đun nóng).
Cao hơn oxit clo Cl 2 O 7 – chất lỏng nhờn không màu, chất phân tử, oxit axit. Khi phản ứng với nước, nó tạo thành axit perchloric HClO 4, axit oxo clo duy nhất tồn tại dưới dạng một chất riêng lẻ; các oxoaxit clo còn lại chỉ được biết đến trong dung dịch nước. Thông tin về các axit clo này được đưa ra trong Bảng 35.
Bảng 35. Axit clo và muối của chúng
C/O |
Công thức |
Tên |
Lực lượng |
Tên |
hydrochloric |
||||
hypochlorous |
hypoclorit |
|||
clorua |
||||
hypochlorous |
||||
peclorat |
Hầu hết clorua đều hòa tan trong nước. Các trường hợp ngoại lệ là AgCl, PbCl 2, TlCl và Hg 2 Cl 2. Tạo kết tủa bạc clorua không màu khi thêm dung dịch bạc nitrat vào dung dịch thử - phản ứng định tínhđối với ion clorua:
Ag + Cl = AgCl
Clo có thể thu được từ natri hoặc kali clorua trong phòng thí nghiệm:
2NaCl + 3H 2 SO 4 + MnO 2 = 2NaHSO 4 + MnSO 4 + 2H 2 O + Cl 2
Là tác nhân oxy hóa khi sản xuất clo bằng phương pháp này, không chỉ mangan dioxide mà còn có thể sử dụng KMnO 4, K 2 Cr 2 O 7, KClO 3.
Natri hypochlorite và kali được bao gồm trong các chất tẩy trắng gia dụng và công nghiệp khác nhau. Thuốc tẩy cũng được sử dụng làm thuốc tẩy và cũng được sử dụng làm chất khử trùng.
Kali clorat được sử dụng trong sản xuất diêm, chất nổ và chế phẩm pháo hoa. Khi đun nóng, nó bị phân hủy:
4KClO 3 = KCl + 3KClO 4;
2KClO 3 = 2KCl + O 2 (với sự có mặt của MnO 2).
Kali peclorat cũng bị phân hủy nhưng ở nhiệt độ cao hơn: KClO 4 = KCl + 2O 2.
1. Viết phương trình phân tử của các phản ứng trong đó phương trình ion được cho trong đoạn văn.
2. Viết các phương trình phản ứng nêu trong đoạn văn dưới dạng miêu tả.
3. Lập các phương trình phản ứng mô tả tính chất hóa học của a) clo, b) hydro clorua (và axit clohydric), c) kali clorua và d) bari clorua.
Tính chất hóa học của hợp chất clo
Các sửa đổi đẳng hướng khác nhau ổn định trong các điều kiện khác nhau yếu tố lưu huỳnh. Trong điều kiện bình thường chất đơn giản lưu huỳnh là một chất kết tinh màu vàng, giòn bao gồm các phân tử tám nguyên tử:

Đây được gọi là lưu huỳnh trực thoi (hoặc -lưu huỳnh) S 8. (Tên này xuất phát từ một thuật ngữ tinh thể học mô tả tính đối xứng của các tinh thể của chất này). Khi đun nóng, nó tan chảy (113 ° C), biến thành chất lỏng màu vàng di động gồm các phân tử giống nhau. Khi đun nóng thêm, các chu trình bị phá vỡ và các phân tử polymer rất dài được hình thành - chất tan chảy sẫm màu và trở nên rất nhớt. Đây là cái gọi là -lưu huỳnh S N. Lưu huỳnh sôi (445 °C) ở dạng phân tử hai nguyên tử S 2, có cấu trúc tương tự như phân tử oxy. Cấu trúc của các phân tử này, giống như cấu trúc của phân tử oxy, không thể được mô tả trong khuôn khổ mô hình liên kết cộng hóa trị. Ngoài ra, còn có những biến đổi đẳng hướng khác của lưu huỳnh.
Trong tự nhiên có trữ lượng lưu huỳnh tự nhiên, từ đó nó được chiết xuất. Hầu hết lưu huỳnh khai thác được sử dụng để sản xuất axit sulfuric. Một phần lưu huỳnh được sử dụng trong nông nghiệp để bảo vệ cây trồng. Lưu huỳnh tinh khiết được sử dụng trong y học để điều trị các bệnh về da.
Từ hợp chất hydro lưu huỳnh, quan trọng nhất là hydro sunfua (monosulfan) H 2 S. Đây là chất khí độc không màu, có mùi trứng thối. Nó hòa tan một chút trong nước. Sự hòa tan là vật lý. Ở một mức độ nhỏ, quá trình phân hủy các phân tử hydro sunfua xảy ra trong dung dịch nước và ở mức độ thấp hơn nữa là tạo thành các ion hydrosulfua (xem Phụ lục 13). Tuy nhiên, dung dịch hydro sunfua trong nước được gọi là axit hydro sunfua (hay nước hydro sunfua).
Khí hiđro sunfua cháy trong không khí:
2H 2 S + 3O 2 = 2H 2 O + SO 2 (có dư oxy).
Một phản ứng định tính đối với sự hiện diện của hydro sunfua trong không khí là sự hình thành chì sunfua đen (làm đen giấy lọc được làm ẩm bằng dung dịch chì nitrat:
H 2 S + Pb 2 + 2H 2 O = PbS + 2H 3O
Phản ứng diễn ra theo hướng này do độ hòa tan của chì sunfua rất thấp.
Ngoài hydro sunfua, lưu huỳnh còn tạo thành các sunfan khác H 2 S N, ví dụ, disulfan H 2 S 2, có cấu trúc tương tự hydro peroxide. Nó cũng là một axit rất yếu; muối của nó là pyrit FeS2.
Phù hợp với khả năng hóa trị của các nguyên tử, lưu huỳnh tạo thành hai oxit: SO2 và SO3 . Sulphur dioxide (thường được gọi là sulfur dioxide) là một loại khí không màu, có mùi hăng gây ho. Sulfur trioxide (tên cũ là sulfuric anhydrit) là chất rắn, cực kỳ hút ẩm, không phân tử, khi đun nóng sẽ biến thành chất phân tử. Cả hai oxit đều có tính axit. Khi phản ứng với nước chúng lần lượt tạo thành sulfur dioxide và sulfur dioxide. axit.
Trong dung dịch loãng, axit sunfuric là một axit mạnh điển hình với tất cả các tính chất đặc trưng của nó.
Axit sulfuric tinh khiết, cũng như các dung dịch đậm đặc của nó, là những tác nhân oxy hóa rất mạnh và các nguyên tử oxy hóa ở đây không phải là nguyên tử hydro mà là các nguyên tử lưu huỳnh, chuyển từ trạng thái oxy hóa +VI sang trạng thái oxy hóa +IV. Kết quả là khi phản ứng với axit sunfuric đậm đặc thường tạo thành lưu huỳnh đioxit, ví dụ:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O;
2KBr + 3H 2 SO 4 = 2KHSO 4 + Br 2 + SO 2 + 2H 2 O.
Do đó, ngay cả những kim loại nằm trong dãy điện áp bên phải hydro (Cu, Ag, Hg) cũng phản ứng với axit sulfuric đậm đặc. Đồng thời, một số kim loại khá hoạt động (Fe, Cr, Al, v.v.) không phản ứng với axit sunfuric đậm đặc, điều này là do trên bề mặt kim loại đó dưới tác dụng của một lớp màng bảo vệ dày đặc được hình thành. axit sunfuric, ngăn chặn quá trình oxy hóa tiếp theo. Hiện tượng này được gọi là sự thụ động.
Là một axit hai bazơ, axit sunfuric tạo thành hai hàng muối: vừa và chua. Muối axit chỉ được phân lập đối với các nguyên tố kiềm và amoni; sự tồn tại của các muối axit khác vẫn còn là vấn đề đáng nghi ngờ.
Hầu hết các sunfat trung bình đều hòa tan trong nước và vì ion sunfat thực tế không phải là bazơ anion nên không trải qua quá trình thủy phân anion.
Các phương pháp công nghiệp hiện đại để sản xuất axit sulfuric dựa trên việc sản xuất sulfur dioxide (giai đoạn 1), quá trình oxy hóa nó thành trioxide (giai đoạn 2) và sự tương tác của sulfur trioxide với nước (giai đoạn 3).
Sulfur dioxide được tạo ra bằng cách đốt lưu huỳnh hoặc các loại sunfua khác nhau trong oxy:
S + O 2 = SO 2;
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Quá trình nung quặng sunfua trong luyện kim màu luôn đi kèm với sự hình thành sulfur dioxide, chất này được sử dụng để sản xuất axit sulfuric.
Trong điều kiện bình thường, không thể oxy hóa sulfur dioxide bằng oxy. Quá trình oxy hóa được thực hiện bằng cách đun nóng với sự có mặt của chất xúc tác - vanadi(V) hoặc oxit bạch kim. Mặc dù phản ứng
2SO 2 + O 2 2SO 3 + Q
đảo ngược, năng suất đạt 99%.
Nếu hỗn hợp khí thu được gồm lưu huỳnh trioxit và không khí được đưa qua nước sạch thì phần lớn lưu huỳnh trioxit không được hấp thụ. Để tránh thất thoát, hỗn hợp khí được dẫn qua axit sulfuric hoặc dung dịch đậm đặc của nó. Điều này tạo ra axit disulfuric:
SO 3 + H 2 SO 4 = H 2 S 2 O 7.
Dung dịch axit disulfuric trong axit sunfuric được gọi là oleum và thường được biểu diễn dưới dạng dung dịch lưu huỳnh trioxit trong axit sunfuric.
Bằng cách pha loãng oleum với nước, bạn có thể thu được cả axit sulfuric tinh khiết và dung dịch của nó.
1.Tạo công thức cấu tạo
a) lưu huỳnh dioxit, b) lưu huỳnh trioxit,
c) axit sulfuric, d) axit disulfuric.
Năm 1774, Karl Scheele, một nhà hóa học đến từ Thụy Điển, lần đầu tiên thu được clo, nhưng người ta tin rằng đó không phải là một nguyên tố riêng biệt mà là một loại axit clohydric (calorizator). Clo nguyên tố đã được G. Davy thu được vào đầu thế kỷ 19, người đã phân hủy muối ăn thành clo và natri bằng điện phân.
Clo (từ tiếng Hy Lạp χλωρός - màu xanh lá cây) là một nguyên tố thuộc nhóm XVII trong bảng tuần hoàn các nguyên tố hóa học D.I. Mendeleev, có số nguyên tử 17 và khối lượng nguyên tử 35,452. Tên gọi được chấp nhận Cl (từ tiếng Latin clo).
Ở trong tự nhiên
Clo là halogen có nhiều nhất trong vỏ trái đất, thường ở dạng hai đồng vị. Do hoạt động hóa học, nó chỉ được tìm thấy ở dạng hợp chất của nhiều khoáng chất.
Clo là chất khí màu vàng lục độc, có mùi nồng, khó chịu, vị ngọt. Chính clo sau khi được phát hiện đã được đề xuất gọi là halogen, nó được xếp vào nhóm cùng tên với tư cách là một trong những phi kim loại hoạt động hóa học mạnh nhất.

Nhu cầu clo hàng ngày
Thông thường, một người trưởng thành khỏe mạnh nên nhận 4-6 g clo mỗi ngày; nhu cầu về nó tăng lên khi hoạt động thể chất tích cực hoặc thời tiết nóng (tăng tiết mồ hôi). Thông thường, cơ thể nhận được nhu cầu hàng ngày từ thực phẩm với chế độ ăn uống cân bằng.
Nguồn cung cấp clo chính cho cơ thể là muối ăn - đặc biệt nếu nó không được xử lý nhiệt, vì vậy tốt hơn nên muối các món ăn làm sẵn. Cũng chứa clo, hải sản, thịt, và, và.

Tương tác với người khác
Sự cân bằng axit-bazơ và nước của cơ thể được điều hòa bởi clo.
Dấu hiệu thiếu clo
Thiếu clo là do các quá trình dẫn đến mất nước của cơ thể - đổ mồ hôi nhiều khi nóng hoặc khi gắng sức, nôn mửa, tiêu chảy và một số bệnh về hệ tiết niệu. Dấu hiệu thiếu clo là thờ ơ và buồn ngủ, yếu cơ, khô miệng rõ ràng, mất vị giác và chán ăn.
Dấu hiệu thừa clo
Dấu hiệu cơ thể dư thừa clo là: tăng huyết áp, ho khan, đau đầu và ngực, đau mắt, chảy nước mắt, rối loạn đường tiêu hóa. Theo nguyên tắc, lượng clo dư thừa có thể xảy ra do uống nước máy thông thường đã trải qua quá trình khử trùng bằng clo và xảy ra ở những người lao động trong các ngành liên quan trực tiếp đến việc sử dụng clo.
Clo trong cơ thể con người:
- điều hòa cân bằng nước và axit-bazơ,
- loại bỏ chất lỏng và muối ra khỏi cơ thể thông qua quá trình điều hòa thẩm thấu,
- kích thích tiêu hóa bình thường,
- bình thường hóa tình trạng của các tế bào hồng cầu,
- làm sạch gan khỏi chất béo.

Công dụng chính của clo là trong công nghiệp hóa chất, nơi nó được sử dụng để sản xuất polyvinyl clorua, bọt polystyrene, vật liệu đóng gói, cũng như các tác nhân chiến tranh hóa học và phân bón thực vật. Khử trùng nước uống bằng clo thực tế là phương pháp lọc nước duy nhất hiện có.
Clo có lẽ đã được các nhà giả kim thuật thu được, nhưng việc phát hiện ra nó và nghiên cứu đầu tiên gắn bó chặt chẽ với tên tuổi của nhà hóa học nổi tiếng người Thụy Điển Carl Wilhelm Scheele. Scheele đã phát hiện ra năm nguyên tố hóa học - bari và mangan (cùng với Johan Hahn), molypden, vonfram, clo và độc lập với các nhà hóa học khác (mặc dù muộn hơn) - ba nguyên tố nữa: oxy, hydro và nitơ. Thành tích này sau đó không nhà hóa học nào có thể lặp lại được. Đồng thời, Scheele, đã được bầu làm thành viên của Viện Hàn lâm Khoa học Hoàng gia Thụy Điển, chỉ là một dược sĩ giản dị ở Köping, mặc dù lẽ ra ông có thể đảm nhận một vị trí danh giá và uy tín hơn. Bản thân Frederick II Đại đế, vua Phổ, đã đề nghị ông làm giáo sư hóa học tại Đại học Berlin. Từ chối những lời đề nghị hấp dẫn như vậy, Scheele nói: “Tôi không thể ăn nhiều hơn mức tôi cần, và số tiền tôi kiếm được ở Köping ở đây chỉ đủ để tôi ăn.”
Tất nhiên, nhiều hợp chất clo đã được biết đến từ rất lâu trước Scheele. Nguyên tố này là một phần của nhiều loại muối, trong đó nổi tiếng nhất là muối ăn. Năm 1774, Scheele tách clo ở dạng tự do bằng cách đun nóng khoáng pyrolusite đen với axit clohydric đậm đặc: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Lúc đầu, các nhà hóa học coi clo không phải là một nguyên tố mà là một hợp chất hóa học của nguyên tố chưa biết muria (từ tiếng Latin muria - nước muối) với oxy. Người ta tin rằng axit clohydric (được gọi là axit muric) có chứa oxy liên kết hóa học. Đặc biệt, điều này đã được “chứng minh” bằng thực tế sau: khi dung dịch clo đứng dưới ánh sáng, oxy thoát ra khỏi nó và axit clohydric vẫn còn trong dung dịch. Tuy nhiên, nhiều nỗ lực nhằm “xé” oxy khỏi clo đều không dẫn đến đâu. Vì vậy, chưa ai có thể thu được carbon dioxide bằng cách đun nóng clo với than (ở nhiệt độ cao, “lấy đi” oxy khỏi nhiều hợp chất chứa nó). Kết quả của các thí nghiệm tương tự được thực hiện bởi Humphry Davy, Joseph Louis Gay-Lussac và Louis Jacques Thenard, người ta thấy rõ rằng clo không chứa oxy và là một chất đơn giản. Các thí nghiệm của Gay-Lussac, người đã phân tích tỷ lệ định lượng của các chất khí trong phản ứng của clo với hydro, đã dẫn đến kết luận tương tự.
Năm 1811, Davy đề xuất tên “chlorin” cho nguyên tố mới - từ tiếng Hy Lạp. "chloros" - màu vàng-xanh. Đây chính xác là màu của clo. Nguồn gốc tương tự là trong từ "chất diệp lục" (từ tiếng Hy Lạp "chloros" và "phyllon" - lá). Một năm sau, Gay-Lussac “rút ngắn” tên thành “clo”. Nhưng người Anh (và người Mỹ) vẫn gọi nguyên tố này là “clo”, trong khi người Pháp gọi nó là clo. Người Đức, những “nhà lập pháp” về hóa học trong gần như toàn bộ thế kỷ 19, cũng sử dụng tên viết tắt này. (trong tiếng Đức clo là Chlor). Năm 1811, nhà vật lý người Đức Johann Schweiger đã đề xuất cái tên “halogen” cho clo (từ tiếng Hy Lạp “hals” - muối và “gennao” - sinh ra). Sau đó, thuật ngữ này không chỉ được gán cho clo mà còn cho tất cả các chất tương tự của nó trong nhóm thứ bảy - flo, brom, iốt, astatine.
Việc trình diễn quá trình đốt cháy hydro trong khí quyển clo rất thú vị: đôi khi trong quá trình thí nghiệm, một tác dụng phụ bất thường xảy ra: nghe thấy âm thanh vo ve. Thông thường, ngọn lửa kêu vo vo khi một ống mỏng cung cấp hydro được hạ xuống một bình hình nón chứa đầy clo; Điều tương tự cũng đúng đối với bình cầu, nhưng ở hình trụ, ngọn lửa thường không kêu. Hiện tượng này được gọi là “ngọn lửa ca hát”.
Trong dung dịch nước, clo phản ứng một phần và khá chậm với nước; ở 25° C, trạng thái cân bằng: Cl 2 + H 2 O HClO + HCl được thiết lập trong vòng hai ngày. Axit hypochlorous phân hủy trong ánh sáng: HClO ® HCl + O. Đó là oxy nguyên tử được cho là có tác dụng tẩy trắng (clo khô tuyệt đối không có khả năng này).
Clo trong các hợp chất của nó có thể thể hiện tất cả các trạng thái oxy hóa - từ –1 đến +7. Với oxy, clo tạo thành một số oxit, tất cả chúng ở dạng nguyên chất đều không ổn định và dễ nổ: Cl 2 O - khí màu vàng cam, ClO 2 - khí màu vàng (dưới 9,7 o C - chất lỏng màu đỏ tươi), clo perchlorate Cl 2 O 4 (ClO –ClO 3, chất lỏng màu vàng nhạt), Cl 2 O 6 (O 2 Cl–O–ClO 3, chất lỏng màu đỏ tươi), Cl 2 O 7 – chất lỏng không màu, rất dễ nổ. Ở nhiệt độ thấp thu được các oxit không bền Cl 2 O 3 và ClO 3. Oxit ClO 2 được sản xuất ở quy mô công nghiệp và được sử dụng thay thế clo để tẩy bột giấy và khử trùng nước uống và nước thải. Với các halogen khác, clo tạo thành một số hợp chất gọi là interhalogen, ví dụ ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Clo và các hợp chất của nó có trạng thái oxy hóa dương là những tác nhân oxy hóa mạnh. Năm 1822, nhà hóa học người Đức Leopold Gmelin thu được muối đỏ từ muối máu màu vàng bằng cách oxy hóa bằng clo: 2K 4 + Cl 2 ® K 3 + 2KCl. Clo dễ dàng oxy hóa bromua và clorua, giải phóng brom và iốt ở dạng tự do.
Clo ở các trạng thái oxy hóa khác nhau tạo thành một số axit: HCl - hydrochloric (hydrochloric, muối - clorua), HClO - hypochlorous (muối - hypochlorite), HClO 2 - chlorous (muối - clorit), HClO 3 - hypochlorous (muối - clorat) , HClO 4 – clo (muối – peclorat). Trong số các axit oxy, chỉ có axit perchloric ổn định ở dạng nguyên chất. Trong số các muối của axit oxy, hypochlorite được sử dụng trong thực tế, natri clorit NaClO 2 - để tẩy vải, để sản xuất nguồn oxy pháo hoa nhỏ gọn (“nến oxy”), kali clorat (muối Bertholometa), canxi và magiê (cho kiểm soát các loài gây hại nông nghiệp, như thành phần của chế phẩm pháo hoa và chất nổ, trong sản xuất diêm), perchlorate - thành phần của thuốc nổ và chế phẩm pháo hoa; Amoni perchlorate là một thành phần của nhiên liệu tên lửa rắn.
Clo phản ứng với nhiều hợp chất hữu cơ. Nó nhanh chóng gắn vào các hợp chất chưa bão hòa có liên kết đôi và ba cacbon-cacbon (phản ứng với axetylen tiến hành bùng nổ) và dưới ánh sáng với benzen. Trong những điều kiện nhất định, clo có thể thay thế nguyên tử hydro trong các hợp chất hữu cơ: R–H + Cl 2 ® RCl + HCl. Phản ứng này đóng một vai trò quan trọng trong lịch sử hóa học hữu cơ. Vào những năm 1840, nhà hóa học người Pháp Jean Baptiste Dumas đã phát hiện ra rằng khi clo phản ứng với axit axetic, phản ứng xảy ra dễ dàng đến kinh ngạc.
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + HCl. Khi dư clo sẽ tạo thành axit trichloroacetic CCl 3 COOH. Tuy nhiên, nhiều nhà hóa học không tin tưởng vào công trình của Dumas. Thật vậy, theo lý thuyết được chấp nhận rộng rãi lúc bấy giờ của Berzelius, các nguyên tử hydro tích điện dương không thể được thay thế bằng các nguyên tử clo tích điện âm. Ý kiến này được đưa ra vào thời điểm đó bởi nhiều nhà hóa học xuất sắc, trong số đó có Friedrich Wöhler, Justus Liebig và tất nhiên, chính Berzelius.
Để chế giễu Dumas, Wöhler đã giao cho người bạn Liebig của mình một bài báo thay mặt cho một S. Windler nào đó (Schwindler - trong tiếng Đức là một kẻ lừa đảo) về một ứng dụng thành công mới của phản ứng được cho là do Dumas phát hiện ra. Trong bài báo, Wöhler đã viết với sự chế nhạo rõ ràng về việc làm thế nào trong mangan axetat Mn(CH 3 COO) 2 có thể thay thế tất cả các nguyên tố, theo hóa trị của chúng, bằng clo, tạo ra một chất kết tinh màu vàng chỉ gồm có clo. Người ta còn nói thêm rằng ở Anh, bằng cách thay thế liên tục tất cả các nguyên tử trong hợp chất hữu cơ bằng nguyên tử clo, các loại vải thông thường được chuyển thành clo, đồng thời mọi thứ vẫn giữ được hình dáng của chúng. Trong một chú thích cuối trang, người ta nói rằng các cửa hàng ở London đang bán rất chạy vật liệu chỉ bao gồm clo, vì chất liệu này rất tốt cho mũ ngủ và quần lót ấm.
Phản ứng của clo với các hợp chất hữu cơ dẫn đến sự hình thành nhiều sản phẩm clo hữu cơ, trong số đó phải kể đến các dung môi được sử dụng rộng rãi là methylene chloride CH 2 Cl 2, cloroform CHCl 3, carbon tetrachloride CCl 4, trichloroethylene CHCl=CCl 2, tetrachloroethylene C 2 Cl 4 . Khi có độ ẩm, clo làm mất màu lá xanh của cây và nhiều loại thuốc nhuộm. Điều này đã được sử dụng vào thế kỷ 18. để tẩy trắng vải.
Clo là một loại khí độc.
Scheele, người đã nhận được clo, nhận thấy có mùi nồng nặc rất khó chịu, khó thở và ho. Sau này chúng tôi phát hiện ra, một người ngửi thấy mùi clo ngay cả khi một lít không khí chỉ chứa 0,005 mg khí này, đồng thời nó đã có tác dụng kích thích đường hô hấp, phá hủy các tế bào của màng nhầy của đường hô hấp. đường và phổi. Nồng độ 0,012 mg/l rất khó dung nạp; nếu nồng độ clo vượt quá 0,1 mg/l, nó sẽ đe dọa tính mạng: thở gấp, co giật, sau đó ngày càng hiếm và sau 5–25 phút thì ngừng thở. Nồng độ tối đa cho phép trong không khí của các doanh nghiệp công nghiệp là 0,001 mg/l và trong không khí của khu dân cư - 0,00003 mg/l.
Viện sĩ St. Petersburg Toviy Egorovich Lovitz, lặp lại thí nghiệm của Scheele vào năm 1790, đã vô tình thải ra một lượng đáng kể clo vào không khí. Sau khi hít phải nó, anh bất tỉnh và ngã xuống, sau đó bị đau ngực dữ dội trong 8 ngày. May mắn thay, anh đã bình phục. Nhà hóa học nổi tiếng người Anh Davy suýt chết vì ngộ độc clo. Các thí nghiệm với một lượng nhỏ clo cũng rất nguy hiểm vì chúng có thể gây tổn thương phổi nghiêm trọng. Người ta nói rằng nhà hóa học người Đức Egon Wiberg đã bắt đầu một trong những bài giảng của mình về clo bằng những lời: “Chlorine là một loại khí độc. Nếu tôi bị nhiễm độc trong cuộc biểu tình tiếp theo, hãy đưa tôi ra ngoài hít thở không khí trong lành. Nhưng thật không may, bài giảng sẽ phải gián đoạn.” Nếu bạn thải nhiều clo vào không khí, nó sẽ trở thành một thảm họa thực sự. Điều này đã được quân đội Anh-Pháp trải qua trong Thế chiến thứ nhất. Sáng ngày 22 tháng 4 năm 1915, bộ chỉ huy Đức quyết định thực hiện vụ tấn công bằng khí độc đầu tiên trong lịch sử các cuộc chiến tranh: khi gió thổi về phía kẻ thù, trên một khu vực nhỏ dài sáu km của mặt trận gần thị trấn Ypres của Bỉ. , van của 5.730 bình được mở đồng thời, mỗi bình chứa 30 kg clo lỏng. Trong vòng 5 phút, một đám mây khổng lồ màu vàng xanh hình thành, từ từ di chuyển khỏi chiến hào của quân Đức về phía quân Đồng minh. Lính Anh và Pháp hoàn toàn không có khả năng tự vệ. Khí xuyên qua các vết nứt vào tất cả các nơi trú ẩn, không có lối thoát: xét cho cùng, mặt nạ phòng độc vẫn chưa được phát minh. Kết quả là 15 nghìn người bị đầu độc, trong đó có 5 nghìn người tử vong. Một tháng sau, vào ngày 31 tháng 5, quân Đức lặp lại cuộc tấn công bằng khí độc ở mặt trận phía đông - nhằm vào quân Nga. Điều này xảy ra ở Ba Lan gần thành phố Bolimova. Ở mặt trận 12 km, 264 tấn hỗn hợp clo và phosgene độc hại hơn nhiều (axit cacbonic clorua COCl 2) đã được giải phóng từ 12 nghìn xi lanh. Bộ chỉ huy Sa hoàng biết về những gì đã xảy ra ở Ypres, nhưng binh lính Nga không có phương tiện phòng thủ! Hậu quả của vụ tấn công bằng hơi độc, thiệt hại lên tới 9.146 người, trong đó chỉ có 108 người do súng trường và pháo kích, số còn lại bị đầu độc. Đồng thời, 1.183 người chết gần như ngay lập tức.
Chẳng bao lâu, các nhà hóa học đã chỉ ra cách thoát khỏi clo: bạn cần thở qua băng gạc ngâm trong dung dịch natri thiosulfate (chất này được sử dụng trong nhiếp ảnh, nó thường được gọi là hyposulfite). Clo phản ứng rất nhanh với dung dịch thiosulfate, oxy hóa nó:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2NaCl + 6HCl. Tất nhiên, axit sulfuric cũng không phải là một chất vô hại, nhưng dung dịch nước pha loãng của nó ít nguy hiểm hơn nhiều so với clo độc. Vì vậy, trong những năm đó, thiosulfate còn có một tên gọi khác - "antichlor", nhưng mặt nạ phòng độc thiosulfate đầu tiên không hiệu quả lắm.
Năm 1916, nhà hóa học người Nga và học giả tương lai Nikolai Dmitrievich Zelinsky đã phát minh ra một mặt nạ phòng độc thực sự hiệu quả, trong đó các chất độc hại được giữ lại bằng một lớp than hoạt tính. Loại than này có bề mặt rất phát triển có thể giữ lại nhiều clo hơn đáng kể so với gạc ngâm trong hyposulfite. May mắn thay, “các cuộc tấn công bằng clo” vẫn chỉ là một giai đoạn bi thảm trong lịch sử. Sau Thế chiến, clo chỉ còn lại những nghề hòa bình.
Sử dụng clo.
Hàng năm, một lượng lớn clo được sản xuất trên toàn thế giới - hàng chục triệu tấn. Chỉ ở Hoa Kỳ vào cuối thế kỷ 20. Khoảng 12 triệu tấn clo được sản xuất hàng năm bằng phương pháp điện phân (vị trí thứ 10 trong số sản xuất hóa chất). Phần lớn trong số đó (lên tới 50%) được dùng cho quá trình clo hóa các hợp chất hữu cơ - để sản xuất dung môi, cao su tổng hợp, polyvinyl clorua và các loại nhựa khác, cao su chloroprene, thuốc trừ sâu, thuốc và nhiều sản phẩm cần thiết và hữu ích khác. Phần còn lại được sử dụng để tổng hợp clorua vô cơ, trong ngành công nghiệp giấy và bột giấy để tẩy trắng bột gỗ và lọc nước. Clo được sử dụng với số lượng tương đối nhỏ trong ngành luyện kim. Với sự trợ giúp của nó, người ta thu được các kim loại rất tinh khiết - titan, thiếc, tantalum, niobi. Đốt cháy hydro trong clo sẽ thu được hydro clorua và từ đó thu được axit clohydric. Clo còn được sử dụng để sản xuất chất tẩy trắng (hypochlorite, thuốc tẩy) và khử trùng nước bằng clo.
Ilya Leenson