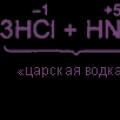Phần này thảo luận về các đặc tính, cách sử dụng clo, tác dụng của nó đối với cơ thể con người, phản ứng trong khí quyển khi được giải phóng, tác hại và phân loại các chất độc hại, hành vi của clo tùy thuộc vào phương pháp lưu trữ, ví dụ về tai nạn tại nhà máy xử lý nước được xem xét .
1.3.1 Điều bất ngờ về clo, tính chất và ứng dụng của nó
Clo hiện nay đã mất đi tầm quan trọng của nó như một chất độc hại, nhưng được sử dụng rất rộng rãi trong các ngành công nghiệp khác nhau. Do đặc tính độc hại của nó, clo được phân loại là chất hóa học khẩn cấp (HAS). Chất nguy hiểm - các chất hoặc hợp chất hóa học, khi đổ hoặc thải từ thùng chứa ra môi trường, có thể gây thương tích lớn cho người và động vật, ô nhiễm không khí, đất, nước, thực vật và các tài sản vật chất khác trên giá trị cho phép. Khi sản xuất mở rộng, ngày càng có nhiều chất độc hại như vậy mỗi năm. Đến nay, hệ thống RSChS bao gồm hơn 34 chất trong danh sách các chất độc hại.
Theo phân loại lâm sàng, clo là chất độc hại thuộc nhóm thứ nhất - chất có tác dụng chủ yếu là gây ngạt thở với tác dụng gây bỏng rõ rệt.
Đặc tính hóa lý. Clo là chất khí màu vàng lục, có mùi hăng, gây ngạt thở. Nó hòa tan kém trong nước, nhưng hòa tan trong một số dung môi hữu cơ. Trong điều kiện thực tế, độ hòa tan của clo trong nước là không đáng kể và lên tới 3 kg trên 1 tấn nước. Ở áp suất bình thường, nó hóa lỏng ở nhiệt độ -34°C, tạo thành chất lỏng nhờn có màu xanh vàng, đông đặc ở nhiệt độ âm 101°C. Clo rắn là tinh thể màu vàng nhạt. Dưới áp suất, clo hóa lỏng ngay cả ở nhiệt độ bình thường. Điểm sôi của clo hóa lỏng là -34,1°C nên ngay cả trong mùa đông clo vẫn ở trạng thái khí. Khi bay hơi tạo thành sương mù màu trắng chứa hơi nước. Một kg clo lỏng tạo ra 0,315 m 3 khí. Nó được hấp phụ tốt bởi than hoạt tính. Về mặt hóa học rất tích cực. 
Nguy cơ cháy nổ của clo. Không cháy nhưng dễ cháy, hỗ trợ quá trình đốt cháy nhiều chất hữu cơ. Dễ nổ khi trộn với hydro. Khi thùng chứa nóng lên, nó sẽ phát nổ.
Tác dụng của clo đối với cơ thể. Theo tác dụng sinh lý đối với cơ thể, clo thuộc nhóm chất có tác dụng gây ngạt thở. Tại thời điểm tiếp xúc, nó có tác dụng kích thích mạnh lên màng nhầy của đường hô hấp và mắt. Dấu hiệu hư hỏng xảy ra ngay sau khi tiếp xúc, vì vậy clo là chất độc hại tác dụng nhanh. Xâm nhập vào đường hô hấp sâu, clo phá hủy mô phổi, gây phù phổi. Tùy thuộc vào nồng độ (độc tính) của clo, mức độ nghiêm trọng của ngộ độc có thể khác nhau. Khi tiếp xúc với clo ngay cả ở nồng độ nhỏ, có thể thấy đỏ kết mạc mắt, vòm miệng mềm và hầu họng, cũng như viêm phế quản, khó thở nhẹ, khàn giọng và cảm giác tức ngực. Ở trong môi trường có chứa clo với nồng độ 1,5–2 g/m 3 kèm theo xuất hiện cảm giác đau ở đường hô hấp trên, nóng rát và đau sau xương ức (cảm giác như bị bóp mạnh ở ngực), nóng rát và đau ở vùng ngực. mắt, chảy nước mắt, ho khan đau đớn. Sau 2-4 giờ, dấu hiệu phù phổi xuất hiện. Khó thở tăng lên, nhịp tim nhanh hơn và bắt đầu tiết ra đờm có bọt màu vàng hoặc đỏ. Tiếp xúc với nồng độ clo cao trong 10–15 phút có thể gây bỏng hóa chất ở phổi và tử vong. Khi hít phải clo ở nồng độ rất cao, tử vong xảy ra trong vòng vài phút do trung tâm hô hấp bị tê liệt. Không có thuốc giải độc chống lại clo. Nồng độ clo tối đa cho phép trong không khí của khu vực làm việc của cơ sở công nghiệp là 1 mg/m3, nhưng một người bắt đầu cảm thấy clo trong không khí khi nồng độ vượt quá 3 mg/m3. Do đó, nếu bạn ngửi thấy mùi clo nồng nặc, ngột ngạt thì làm việc mà không có thiết bị bảo hộ đã nguy hiểm rồi. Tác dụng kích thích xảy ra ở nồng độ khoảng 10 mg/m3. Tiếp xúc với nồng độ 100–200 mg/m3 clo trong 30–60 phút sẽ nguy hiểm đến tính mạng. Nồng độ clo tối đa cho phép trong không khí của khu dân cư là: trung bình ngày 0,03 mg/m 3 ; liều duy nhất tối đa 0,1 mg/m3. 
Dấu hiệu thiệt hại của clo. Đốt nặng, đau mắt; chảy nước mắt; thở nhanh; ho khan đau đớn; hưng phấn mạnh mẽ; nỗi sợ; trong trường hợp nặng, ngừng thở. Nếu có rò rỉ hoặc tràn clo, không chạm vào chất bị đổ, vì clo còn lại trong vết tràn sẽ nguội đi đến nhiệt độ -34°C.
Cách sử dụng. Nó được sử dụng rộng rãi để tẩy vải và bột giấy, trong sản xuất nhựa, cao su, thuốc trừ sâu, dichloroethane, trong luyện kim màu, cũng như trong các dịch vụ khử trùng nước của thành phố. Clo chỉ được lưu trữ và vận chuyển đến nơi tiêu thụ ở trạng thái hóa lỏng. Phương pháp lưu trữ và vận chuyển clo lỏng phổ biến nhất là lưu trữ dưới áp suất tương ứng với áp suất của hơi clo bão hòa ở nhiệt độ môi trường. Nó thường được lưu trữ trong các bể hình trụ (10–250 m3) và hình cầu (600–2000 m3) ở trạng thái hóa lỏng dưới áp suất hơi riêng của nó, giá trị của nó phụ thuộc vào nhiệt độ của clo lỏng. Ở nhiệt độ 25°C nó là 8 kgf/cm2, và ở nhiệt độ 60°C – 18 kgf/cm2. Clo hóa lỏng được vận chuyển trong các thùng chứa, thùng chứa và xi lanh đường sắt, cũng có thể dùng làm nơi lưu trữ tạm thời.
Hành vi trong khí quyển. Khi thùng chứa bị phá hủy, clo sẽ bay hơi nhanh chóng (tùy thuộc vào áp suất). Tỷ lệ clo bay hơi ngay lập tức phụ thuộc vào nhiệt độ của clo lỏng được lưu trữ. Nhiệt độ càng cao thì tỷ lệ clo bay hơi gần như ngay lập tức trong trường hợp khẩn cấp càng lớn (20% ở 20°C và 30% ở 40°C). Trong trường hợp này, cái gọi là đám mây sơ cấp được hình thành với nồng độ vượt quá đáng kể nồng độ gây chết người. Thời gian tác hại của đám mây clo sơ cấp ở khoảng cách ngắn tính từ nơi xảy ra tai nạn sẽ dao động từ vài chục giây đến vài phút. Đám mây thứ cấp, được hình thành trong quá trình bay hơi clo từ khu vực đóng chai, được đặc trưng bởi nồng độ của chất này trong đó thấp hơn 2–3 bậc độ lớn so với đám mây chính. Tuy nhiên, thời gian tác dụng trong đám mây clo này dài hơn nhiều và được xác định bởi thời gian bay hơi của chất lỏng tràn ra. Sự bay hơi xảy ra do sức nóng của chảo hoặc bề mặt bên dưới cũng như không khí xung quanh. Thời gian bay hơi phụ thuộc vào lượng chất, tính chất tràn: vào chảo hay tự do (vào bờ kè) và vào điều kiện khí tượng. Sự bay hơi có thể kéo dài vài giờ hoặc thậm chí vài ngày. Khí clo nặng hơn không khí 2,5 lần nên đám mây clo di chuyển theo hướng gió gần mặt đất. Có khả năng xuyên thấu tốt vào các cấu trúc bị rò rỉ. Nó có thể tích tụ ở những khu vực thấp, tầng hầm nhà ở, giếng nước, đường hầm và các công trình bảo vệ không được trang bị bảo vệ hóa học. Ranh giới bên ngoài của vùng nhiễm trùng được coi là đường ngưỡng nhiễm độc trung bình gây ra các triệu chứng ban đầu của tổn thương (0,6). 

Ở quy mô công nghiệp, clo được sản xuất cùng với natri hydroxit và hydro bằng cách điện phân dung dịch muối ăn:
2NaCl + 2H 2 O → H 2 + Cl 2 + 2NaOH
Cực dương: 2Cl - - 2e - → Cl 2 0
Cực âm: 2H 2 O + 2e - → H 2 + 2OH -
Tại các nhà máy xử lý nước, clo được lưu trữ trong các “bể” đặc biệt hoặc được bơm vào các bình thép áp suất cao. Xi lanh chứa clo lỏng dưới áp suất có màu đặc biệt - màu đầm lầy. Cần lưu ý rằng trong quá trình sử dụng bình chứa clo kéo dài, nitơ triclorua cực kỳ dễ nổ sẽ tích tụ trong đó, và do đó, thỉnh thoảng, bình chứa clo phải được rửa và làm sạch định kỳ bằng nitơ clorua.
Nồng độ clo tối đa cho phép trong không khí như sau: trung bình hàng ngày - 0,03 mg/m³; tối đa một lần - 0,1 mg/m³; trong cơ sở làm việc của một doanh nghiệp công nghiệp - 1 mg/m³.
Thành phần của nhóm con VII trong Bảng tuần hoàn của D.I. Mendeleev. Ở cấp độ bên ngoài có 7 electron nên khi tương tác với chất khử, clo thể hiện tính chất oxy hóa, hút một electron kim loại về phía mình.
Tính chất vật lý của clo.
Clo là chất khí màu vàng. Có mùi hăng.
Tính chất hóa học của clo.
Miễn phí clo rất tích cực. Nó phản ứng với tất cả các chất đơn giản ngoại trừ oxy, nitơ và khí hiếm:
Sĩ + 2 Cl 2 = SiCl 4 + Q.
Khi tương tác với hydro ở nhiệt độ phòng, thực tế không có phản ứng nào xảy ra, nhưng ngay khi ánh sáng đóng vai trò là tác động bên ngoài, một phản ứng dây chuyền sẽ xảy ra, phản ứng này đã được ứng dụng trong hóa học hữu cơ.
Khi đun nóng, clo có khả năng đẩy iốt hoặc brom ra khỏi axit của chúng:
Cl 2 + 2 HBr = 2 HCl + anh 2 .
Clo phản ứng với nước, hòa tan một phần trong đó. Hỗn hợp này được gọi là nước clo.
Phản ứng với kiềm:
Cl 2 + 2NaOH = NaCl + NaClO + H 2 O (lạnh lẽo),
Cl 2 + 6KOH = 5KCl + KClO 3 + 3 H 2 O (nhiệt).
Thu được clo.
1. Điện phân natri clorua tan chảy, tiến hành theo sơ đồ sau:
2. Phương pháp sản xuất clo trong phòng thí nghiệm:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O.
Nó được sử dụng rộng rãi trong công nghiệp, nông nghiệp, cho nhu cầu y tế và gia đình. Sản lượng clo hàng năm trên thế giới là 55,5 triệu tấn: do sự phân bố rộng rãi của chất này nên các tai nạn liên quan đến sự rò rỉ của nó khá thường xuyên (xảy ra cả tại các cơ sở công nghiệp và trong quá trình vận chuyển clo).
Thông thường, không chỉ cơ sở công nghiệp bị hư hỏng mà cả các khu vực bên ngoài nó (do tính chất vật lý và hóa học của clo: nặng hơn không khí 2,5 lần nên tích tụ ở vùng đất thấp, nguồn nước bị ô nhiễm, do clo bị tan nhiều trong nước).
Vì vậy, kiến thức về các cơ sở kinh tế sản xuất hoặc sử dụng clo, triệu chứng ngộ độc clo, kỹ năng sơ cứu cũng như kiến thức về PPE sử dụng trong khu vực bị ô nhiễm đặc biệt phù hợp hiện nay.
Trước khi kiểm tra clo như một chất độc hại, xác định các triệu chứng ngộ độc với hóa chất này và xác định tiền cấp cứu và sơ cứu là gì, cần phải làm quen với các đặc điểm chung và lĩnh vực sử dụng của nó.
Clo (từ tiếng Hy Lạp - "xanh"). Công thức hóa học – Cl2 (trọng lượng phân tử – 70,91). Hợp chất với clo (khí hydro clorua) được D. Priestley điều chế lần đầu tiên vào năm 1772. Hai năm sau, K.V. Scheele thu được clo ở “dạng tinh khiết”.
Mật độ của clo lỏng là 1560 kg/m3. Nó không bắt lửa và phản ứng: trong ánh sáng ở nhiệt độ cao (ví dụ, trong trường hợp hỏa hoạn), nó tương tác với hydro (nổ), có thể dẫn đến hình thành một loại khí nguy hiểm hơn - phosgene.
Clo được sử dụng trong nhiều lĩnh vực công nghiệp, khoa học và thường là trong cuộc sống hàng ngày. Chúng tôi liệt kê các lĩnh vực sử dụng clo trong công nghiệp:
– nó được sử dụng trong sản xuất polyvinyl clorua, cao su tổng hợp, hợp chất nhựa (những vật liệu này được sử dụng để sản xuất vải sơn, quần áo, giày dép, dây cách điện, v.v.);
– trong công nghiệp giấy và bột giấy, clo được dùng để tẩy giấy và bìa cứng (nó còn được dùng để tẩy vải);
– tham gia vào việc sản xuất thuốc trừ sâu clo hữu cơ (những chất này tiêu diệt côn trùng gây hại trên cây trồng, được sử dụng trong nông nghiệp);
– nó được sử dụng trong quá trình khử trùng (“khử trùng bằng clo”) nước uống và xử lý nước thải;
– nó được sử dụng rộng rãi trong sản xuất hóa chất muối berthollet, thuốc, thuốc tẩy, chất độc, axit clohydric, clorua kim loại;
– trong luyện kim, nó được sử dụng để sản xuất kim loại nguyên chất;
– chất này được sử dụng làm chất chỉ thị neutrino mặt trời.
Clo được lưu trữ trong bể hình trụ (10...250 m3) và bể hình cầu (600...2.000 m3) dưới áp suất hơi riêng (lên tới 1,8 MPa). Nó hóa lỏng dưới áp suất ở nhiệt độ bình thường. Vận chuyển bằng container, xi lanh, bể chứa làm nơi chứa tạm thời.
Bộ Giáo dục và Khoa học LIÊN BANG NGA
Cơ quan giáo dục ngân sách nhà nước liên bang về giáo dục chuyên nghiệp đại học
TRƯỜNG ĐẠI HỌC CÔNG NGHỆ HÓA TIỂU BANG IVANOVSK
Sở TP và MET
Tiểu luận
Clo: tính chất, ứng dụng, sản xuất
Người đứng đầu: Efremov A.M.
Ivanovo 2015
Giới thiệu
Thông tin chung về clo
Sử dụng clo
Phương pháp hóa học sản xuất clo
Điện phân. Khái niệm và bản chất của quá trình
Sản xuất clo công nghiệp
Các biện pháp an toàn trong sản xuất clo và bảo vệ môi trường
Phần kết luận
Giới thiệu
điện phân nguyên tố hóa học clo
Do việc sử dụng clo ở quy mô lớn trong các lĩnh vực khoa học, công nghiệp, y học và trong cuộc sống hàng ngày, nhu cầu về nó gần đây đã tăng lên một cách thảm khốc. Có nhiều phương pháp sản xuất clo bằng phương pháp phòng thí nghiệm và công nghiệp, nhưng chúng đều có nhiều nhược điểm hơn là ưu điểm. Ví dụ, thu được clo từ axit clohydric, sản phẩm phụ và chất thải của nhiều ngành hóa chất và các ngành công nghiệp khác, hoặc muối ăn được khai thác trong các mỏ muối, là một quá trình khá tiêu tốn năng lượng, có hại từ quan điểm môi trường và rất nguy hiểm đến tính mạng và sức khỏe.
Hiện nay, vấn đề phát triển một công nghệ sản xuất clo loại bỏ được tất cả các nhược điểm trên mà vẫn đạt hiệu suất clo cao là rất cấp bách.
.Thông tin chung về clo
Clo thu được lần đầu tiên vào năm 1774 bởi K. Scheele bằng cách cho axit clohydric phản ứng với pyrolusite MnO2. Tuy nhiên, chỉ đến năm 1810 G. Davy mới xác định được clo là một nguyên tố và đặt tên là clo (từ tiếng Hy Lạp chloros - màu vàng-lục). Năm 1813, J. L. Gay-Lussac đề xuất cái tên “Chlorine” cho nguyên tố này.
Clo là nguyên tố thuộc nhóm VII trong bảng tuần hoàn các nguyên tố của D.I. Mendeleev. Trọng lượng phân tử 70,906, trọng lượng nguyên tử 35,453, số nguyên tử 17, thuộc họ halogen. Trong điều kiện bình thường, clo tự do, bao gồm các phân tử hai nguyên tử, là chất khí màu vàng lục, không cháy, có mùi hăng và khó chịu đặc trưng. Nó độc và gây ngạt thở. Khí clo nén ở áp suất khí quyển biến thành chất lỏng màu hổ phách ở -34,05 °C, đông đặc ở -101,6 °C và áp suất 1 atm. Thông thường, clo là hỗn hợp của 75,53% 35Cl và 24,47% 37Cl. Trong điều kiện bình thường, mật độ của khí clo là 3,214 kg/m3, nghĩa là nặng hơn không khí khoảng 2,5 lần.
Về mặt hóa học, clo rất hoạt động, kết hợp trực tiếp với hầu hết các kim loại (chỉ một số khi có độ ẩm hoặc khi đun nóng) và với các phi kim loại (trừ carbon, nitơ, oxy, khí trơ), tạo thành clorua tương ứng, phản ứng với nhiều hợp chất, thay thế hydro trong hydrocacbon bão hòa và kết hợp với các hợp chất chưa bão hòa. Điều này là do sự đa dạng của các ứng dụng của nó. Clo đẩy brom và iốt ra khỏi hợp chất của chúng bằng hydro và kim loại. Các kim loại kiềm, khi có vết ẩm, phản ứng với clo khi bốc cháy; hầu hết các kim loại chỉ phản ứng với clo khô khi đun nóng. Thép, cũng như một số kim loại, có khả năng chịu được khí quyển clo khô ở nhiệt độ thấp, vì vậy chúng được sử dụng để sản xuất thiết bị và phương tiện lưu trữ clo khô. Phốt pho bốc cháy trong môi trường clo, tạo thành PCl3 và tiếp tục clo hóa - PCl5. Lưu huỳnh với clo khi đun nóng tạo ra S2Cl2, SCl2 và SnClm khác. Asen, antimon, bismuth, stronti, Tellurium phản ứng mạnh với clo. Hỗn hợp clo và hydro cháy với ngọn lửa không màu hoặc màu vàng lục tạo thành hydro clorua (đây là phản ứng dây chuyền). Nhiệt độ tối đa của ngọn lửa hydro-clo là 2200°C. Hỗn hợp clo với hydro chứa từ 5,8 đến 88,5% H2 dễ nổ và có thể phát nổ do ánh sáng, tia lửa điện, nhiệt hoặc do sự có mặt của một số chất, chẳng hạn như oxit sắt.
Với oxy, clo tạo thành các oxit: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, cũng như hypochlorite (muối của axit hypochlorous), clorit, clorat và perchlorate. Tất cả các hợp chất oxy của clo tạo thành hỗn hợp dễ nổ với các chất dễ bị oxy hóa. Oxit clo không ổn định và có thể tự phát nổ; hypochlorite phân hủy chậm trong quá trình bảo quản; clorat và perchlorate có thể phát nổ dưới tác động của chất khơi mào. Clo trong nước bị thủy phân tạo thành axit hypoclorơ và axit clohiđric: Cl2 + H2O? HClO + HCl. Dung dịch màu vàng thu được thường được gọi là nước clo. Khi dung dịch kiềm được clo hóa ở nhiệt độ lạnh, hypoclorit và clorua được hình thành: 2NaOH + Cl2 = NaClO + NaCl + H2O, và khi đun nóng, clorat được hình thành. Clo hóa canxi hydroxit khô tạo ra chất tẩy trắng. Khi amoniac phản ứng với clo, nitơ triclorua được hình thành. Khi clo hóa các hợp chất hữu cơ, clo sẽ thay thế hydro hoặc liên kết nhiều liên kết, tạo thành các hợp chất hữu cơ chứa clo khác nhau. Clo tạo thành hợp chất interhalogen với các halogen khác. Clo florua ClF, ClF3, ClF3 rất dễ phản ứng; ví dụ, trong môi trường ClF3, bông thủy tinh tự bốc cháy. Các hợp chất được biết đến của clo với oxy và flo là clo oxyflorua: ClO3F, ClO2F3, ClOF, ClOF3 và flo perchlorate FClO4.
Clo trong tự nhiên chỉ tồn tại ở dạng hợp chất. Hàm lượng trung bình của nó trong vỏ trái đất là 1,7·10-2% khối lượng. Sự di chuyển của nước đóng một vai trò quan trọng trong lịch sử clo trong vỏ trái đất. Nó được tìm thấy ở dạng ion Cl- trong Đại dương Thế giới (1,93%), nước muối ngầm và hồ muối. Số lượng khoáng chất riêng (chủ yếu là clorua tự nhiên) là 97, trong đó chủ yếu là halit NaCl (muối đá). Các mỏ lớn kali, magie clorua và clorua hỗn hợp còn được biết đến: sylvinite KCl, sylvinite (Na,K)Cl, Carnalite KCl MgCl2 6H2O, kainite KCl MgSO4 3H2O, bischofite MgCl2 6H2O. Trong lịch sử Trái đất, việc cung cấp HCl có trong khí núi lửa cho phần trên của vỏ trái đất có tầm quan trọng rất lớn.
Tiêu chuẩn chất lượng clo
Tên chỉ thị GOST 6718-93 Cấp cao nhất Cấp một Tỷ lệ thể tích clo, không nhỏ hơn, % 99,899.6 Tỷ lệ khối lượng của nước, không quá % 0,010,04 Tỷ lệ khối lượng nitơ triclorua, không quá % 0,0020,004 Khối lượng phần dư lượng không bay hơi, không quá %0 .0150.10
Lưu trữ và vận chuyển clo
Clo được sản xuất bằng nhiều phương pháp khác nhau được lưu trữ trong các “bể” đặc biệt hoặc được bơm vào các xi lanh hình trụ bằng thép (thể tích 10-250 m3) và hình cầu (thể tích 600-2000 m3) dưới áp suất hơi riêng của nó là 18 kgf/cm2. Khối lượng lưu trữ tối đa là 150 tấn. Xi lanh chứa clo lỏng dưới áp suất có màu đặc biệt - màu bảo vệ. Nếu bình clo giảm áp suất, một lượng khí thoát ra đột ngột sẽ xảy ra với nồng độ cao hơn nhiều lần so với nồng độ gây chết người. Cần lưu ý rằng khi sử dụng bình chứa clo trong thời gian dài, nitơ triclorua cực kỳ dễ nổ sẽ tích tụ trong đó, và do đó, thỉnh thoảng, bình chứa clo phải được rửa và làm sạch định kỳ bằng nitơ clorua. Clo được vận chuyển trong các thùng chứa, bồn chứa đường sắt và xi lanh, dùng làm nơi lưu trữ tạm thời.
2.Sử dụng clo
Clo được ngành công nghiệp hóa chất tiêu thụ chủ yếu để sản xuất các dẫn xuất clo hữu cơ khác nhau dùng để sản xuất nhựa, cao su tổng hợp, sợi hóa học, dung môi, thuốc trừ sâu, v.v. Hiện nay, hơn 60% sản lượng clo toàn cầu được sử dụng để tổng hợp hữu cơ. Ngoài ra, clo còn được sử dụng để sản xuất axit clohydric, thuốc tẩy, clorat và các sản phẩm khác. Một lượng đáng kể clo được sử dụng trong luyện kim để khử trùng bằng clo trong quá trình xử lý quặng đa kim, tách vàng từ quặng và nó cũng được sử dụng trong công nghiệp lọc dầu, trong nông nghiệp, y học và vệ sinh, để trung hòa nước uống và nước thải. , trong pháo hoa và một số lĩnh vực khác của nền kinh tế quốc dân. . Nhờ sự phát triển của các khu vực sử dụng clo, chủ yếu là do sự thành công của quá trình tổng hợp hữu cơ, sản lượng clo trên thế giới là hơn 20 triệu tấn/năm.
Các ví dụ chính về ứng dụng và sử dụng clo trong các ngành khoa học, công nghiệp và nhu cầu sinh hoạt khác nhau:
1.trong sản xuất polyvinyl clorua, hợp chất nhựa, cao su tổng hợp, từ đó họ tạo ra: dây cách điện, khung cửa sổ, vật liệu đóng gói, quần áo và giày dép, vải sơn và hồ sơ, vecni, thiết bị và nhựa xốp, đồ chơi, bộ phận dụng cụ, vật liệu xây dựng. Polyvinyl clorua được sản xuất bằng cách trùng hợp vinyl clorua, ngày nay thường được sản xuất từ ethylene bằng phương pháp cân bằng clo thông qua 1,2-dichloroethane trung gian.
CH2=CH2+Cl2=>CH2Cl-CH2ClCl-CH2Cl=> CH2=CHCl+HCl
1)như một chất tẩy trắng (mặc dù bản thân clo không phải là chất “tẩy trắng” mà là oxy nguyên tử, được hình thành trong quá trình phân hủy axit hypochlorous theo phản ứng: Cl2 + H2O ? HCl + HClO ? 2HCl + O*).
2)trong sản xuất thuốc trừ sâu organochlorine - chất diệt côn trùng gây hại cho cây trồng nhưng an toàn cho cây trồng (aldrin, DDT, hexachlorane). Một trong những loại thuốc trừ sâu quan trọng nhất là hexachlorocyclohexane (C6H6Cl6).
)được sử dụng làm tác nhân chiến tranh hóa học, cũng như sản xuất các tác nhân chiến tranh hóa học khác: khí mù tạt (C4H8Cl2S), phosgene (CCl2O).
)để khử trùng nước - clo hóa. Phương pháp khử trùng nước uống phổ biến nhất dựa trên khả năng của clo tự do và các hợp chất của nó để ức chế hệ thống enzyme của vi sinh vật xúc tác cho quá trình oxy hóa khử. Để khử trùng nước uống, những chất sau đây được sử dụng: clo (Cl2), clo dioxide (ClO2), cloramin (NH2Cl) và thuốc tẩy (Ca(Cl)OCl).
)trong ngành công nghiệp thực phẩm nó được đăng ký là phụ gia thực phẩm E925.
)trong sản xuất hóa chất xút (NaOH) (dùng sản xuất rayon, trong công nghiệp xà phòng), axit clohydric (HCl), thuốc tẩy, muối bertholite (KClO3), clorua kim loại, chất độc, thuốc, phân bón.
)trong luyện kim để sản xuất kim loại nguyên chất: titan, thiếc, tantalum, niobi.
TiO2 + 2C + 2Cl2 => TiCl4 + 2CO;
TiCl4 + 2Mg => 2MgCl2 + Ti (ở T=850°C)
)như một chỉ báo về neutrino mặt trời trong máy dò clo-argon (Ý tưởng về một “máy dò clo” để ghi nhận neutrino mặt trời được đề xuất bởi nhà vật lý nổi tiếng Liên Xô, Viện sĩ B. Pontecorvo và được thực hiện bởi nhà vật lý người Mỹ R. Davis và các cộng tác viên của ông. Sau khi bắt được hạt nhân neutrino của đồng vị clo có trọng lượng nguyên tử 37, biến thành hạt nhân của đồng vị argon-37, tạo ra một electron có thể đăng ký.).
Nhiều nước phát triển tìm cách hạn chế sử dụng clo trong cuộc sống hàng ngày, bao gồm cả việc đốt chất thải có chứa clo tạo ra một lượng đáng kể dioxin (chất độc sinh thái toàn cầu có đặc tính gây đột biến mạnh).
3.Phương pháp hóa học sản xuất clo
Trước đây, việc sản xuất clo bằng phương pháp hóa học sử dụng phương pháp Weldon và Deacon là phổ biến. Trong các quá trình này, clo được tạo ra bởi quá trình oxy hóa hydro clorua được hình thành như một sản phẩm phụ trong quá trình sản xuất natri sunfat từ muối ăn nhờ tác dụng của axit sulfuric.
phản ứng xảy ra bằng phương pháp Weldon:
4HCl + MnO2 =>MnCl2+ 2H2O + Cl2
phản ứng xảy ra theo phương pháp Deacon:
HCl + O2 =>2H2O + 2Cl2
Trong quy trình Dikonovsky, clorua đồng được sử dụng làm chất xúc tác, dung dịch 50% trong đó (đôi khi có thêm NaCl) được ngâm tẩm với chất mang gốm xốp. Nhiệt độ phản ứng tối ưu trên chất xúc tác như vậy thường nằm trong khoảng 430-490°. Chất xúc tác này dễ bị nhiễm độc bởi các hợp chất asen, tạo thành arsenate đồng không hoạt động, cũng như sulfur dioxide và sulfur trioxide. Sự hiện diện của một lượng nhỏ hơi axit sulfuric trong khí làm giảm mạnh hiệu suất clo do các phản ứng tuần tự:
H2SO4 => SO2 + 1/2O2 + H2O+ C12 + 2H2O => 2НCl + H2SO4
C12 + H2O => 1/2O2 + 2HCl
Vì vậy, axit sunfuric là chất xúc tác thúc đẩy quá trình chuyển đổi ngược Cl2 thành HCl. Vì vậy, trước khi oxy hóa trên chất xúc tác đồng, khí hydrochloride phải được làm sạch hoàn toàn khỏi các tạp chất làm giảm hiệu suất thu clo.
Hệ thống lắp đặt của Deacon bao gồm một lò sưởi gas, một bộ lọc khí và một thiết bị tiếp xúc có vỏ hình trụ bằng thép, bên trong có hai xi lanh gốm đặt đồng tâm có lỗ; không gian hình khuyên giữa chúng được lấp đầy bằng chất xúc tác. Hydro clorua bị oxy hóa bởi không khí nên clo bị pha loãng. Một hỗn hợp chứa 25% thể tích HCl và 75% thể tích không khí (~16% O2) được đưa vào thiết bị tiếp xúc và khí rời khỏi thiết bị chứa khoảng 8% C12, 9% HCl, 8% hơi nước và 75% không khí . Loại khí này sau khi rửa bằng HCl và làm khô bằng axit sulfuric thường được sử dụng để sản xuất thuốc tẩy.
Việc khôi phục quy trình Deacon hiện dựa trên quá trình oxy hóa hydro clorua không phải bằng không khí mà bằng oxy, điều này giúp thu được clo đậm đặc bằng cách sử dụng các chất xúc tác có hoạt tính cao. Hỗn hợp clo-oxy thu được được rửa liên tiếp khỏi cặn HC1 bằng axit clohydric 36 và 20% và làm khô bằng axit sulfuric. Clo sau đó được hóa lỏng và oxy được đưa trở lại quá trình. Clo cũng được tách ra khỏi oxy bằng cách hấp thụ clo dưới áp suất 8 atm bằng lưu huỳnh clorua, sau đó được tái sinh để tạo ra 100% clo:
Cl2 + S2CI2
Các chất xúc tác ở nhiệt độ thấp được sử dụng, ví dụ, đồng dichloride được kích hoạt bằng muối của kim loại đất hiếm, giúp thực hiện quá trình ngay cả ở 100°C và do đó làm tăng mạnh mức độ chuyển đổi HCl thành Cl2. Trên chất xúc tác oxit crom, HCl được đốt cháy trong oxy ở nhiệt độ 340-480°C. Việc sử dụng chất xúc tác từ hỗn hợp V2O5 với pyrosulfate kim loại kiềm và chất kích hoạt trên silica gel ở 250–20°C được mô tả. Cơ chế và động học của quá trình này đã được nghiên cứu và các điều kiện tối ưu để thực hiện nó đã được thiết lập, đặc biệt là trong tầng sôi.
Quá trình oxy hóa hydro clorua bằng oxy cũng được thực hiện bằng cách sử dụng hỗn hợp FeCl3 + KCl nóng chảy trong hai giai đoạn, được thực hiện trong các lò phản ứng riêng biệt. Trong lò phản ứng đầu tiên, clorua sắt bị oxy hóa tạo thành clo:
2FeCl3 + 1
Trong lò phản ứng thứ hai, clorua sắt được tái sinh từ oxit sắt bằng hydro clorua:
O3 + 6HCI = 2FeCl3 + 3H20
Để giảm áp suất hơi của clorua sắt, kali clorua được thêm vào. Người ta cũng đề xuất thực hiện quá trình này trong một thiết bị, trong đó khối tiếp xúc bao gồm Fe2O3, KC1 và đồng, coban hoặc niken clorua lắng đọng trên chất mang trơ sẽ di chuyển từ trên xuống dưới của thiết bị. Ở phía trên của thiết bị, nó đi qua vùng clo hóa nóng, tại đây Fe2O3 được chuyển thành FeCl3, tương tác với HCl nằm trong dòng khí đi từ dưới lên trên. Sau đó, khối tiếp xúc được hạ xuống vùng làm mát, tại đây, dưới tác dụng của oxy, nguyên tố clo được hình thành và FeCl3 chuyển thành Fe2O3. Khối tiếp xúc bị oxy hóa được đưa trở lại vùng clo hóa.
Quá trình oxy hóa gián tiếp tương tự HCl thành Cl2 được thực hiện theo sơ đồ sau:
2HC1 + MgO = MgCl2 + H2O
Người ta đề xuất sản xuất đồng thời clo và axit sulfuric bằng cách cho khí chứa HCl, O2 và một lượng lớn SO2 dư qua chất xúc tác vanadi ở 400600°C. Sau đó H2SO4 và HSO3Cl được ngưng tụ từ khí và SO3 được hấp thụ bằng axit sunfuric; clo vẫn ở pha khí. HSO3Cl bị thủy phân và HC1 giải phóng được đưa trở lại quá trình.
Quá trình oxy hóa còn được thực hiện hiệu quả hơn nhờ các tác nhân oxy hóa như PbO2, KMnO4, KClO3, K2Cr2O7:
2KMnO4 + 16HCl => 2KCl + 2MnCl2 + 5Cl2^ +8H2O
Clo cũng có thể thu được bằng cách oxy hóa clorua. Ví dụ, khi NaCl và SO3 tương tác với nhau sẽ xảy ra các phản ứng sau:
NaCl + 2SO3 = 2NaSO3Cl
NaSO3Cl = Cl2 + SO2 + Na2SO4
NaSO3Cl phân hủy ở 275°C. Hỗn hợp khí SO2 và C12 có thể được tách ra bằng cách hấp thụ clo SO2Cl2 hoặc CCl4 hoặc đưa nó vào quá trình chỉnh lưu, dẫn đến hỗn hợp azeotropic chứa 88 mol. %Cl2 và 12 mol. %SO2. Hỗn hợp đẳng phí có thể được phân tách sâu hơn bằng cách chuyển SO2 thành SO2C12 và tách clo dư, và SO2Cl2 phân hủy ở 200° thành SO2 và Cl2, được thêm vào hỗn hợp được gửi đi tinh chỉnh.
Clo có thể thu được bằng cách oxy hóa clorua hoặc hydro clorua bằng axit nitric, cũng như nitơ dioxide:
ZHCl + HNO3 => Сl2 + NOCl + 2Н2O
Một cách khác để thu được clo là phân hủy nitrosyl clorua, có thể đạt được bằng quá trình oxy hóa:
NOCl + O2 = 2NO2 + Cl2
Ví dụ, người ta cũng đề xuất oxy hóa NOCl bằng axit nitric 75% để thu được clo:
2NOCl + 4HNO3 = Cl2 + 6NO2 + 2H2O
Hỗn hợp clo và nitơ dioxide được tách ra, chuyển NO2 thành axit nitric yếu, sau đó được sử dụng để oxy hóa HCl trong giai đoạn đầu của quá trình tạo thành Cl2 và NOCl. Khó khăn chính khi thực hiện quá trình này ở quy mô công nghiệp là loại bỏ sự ăn mòn. Gốm sứ, thủy tinh, chì, niken và nhựa được sử dụng làm vật liệu cho thiết bị. Sử dụng phương pháp này ở Mỹ năm 1952-1953. Nhà máy đang hoạt động với công suất 75 tấn clo/ngày.
Một phương pháp tuần hoàn đã được phát triển để sản xuất clo bằng cách oxy hóa hydro clorua bằng axit nitric mà không tạo thành nitrosyl clorua theo phản ứng:
2HCl + 2HNO3 = Cl2 + 2NO2 + 2H2O
Quá trình xảy ra ở pha lỏng ở nhiệt độ 80°C, hiệu suất clo đạt 100%, thu được NO2 ở dạng lỏng.
Sau đó, các phương pháp này đã được thay thế hoàn toàn bằng phương pháp điện hóa, nhưng hiện nay các phương pháp hóa học để sản xuất clo đang được hồi sinh trở lại trên cơ sở kỹ thuật mới. Tất cả chúng đều dựa trên quá trình oxy hóa trực tiếp hoặc gián tiếp HCl (hoặc clorua), với tác nhân oxy hóa phổ biến nhất là oxy trong khí quyển.
Điện phân. Khái niệm và bản chất của quá trình
Điện phân là một tập hợp các quá trình oxi hóa khử điện hóa xảy ra trên các điện cực trong quá trình dòng điện trực tiếp đi qua chất nóng chảy hoặc dung dịch có các điện cực được ngâm trong đó.
Cơm. 4.1. Các quá trình xảy ra trong quá trình điện phân. Sơ đồ bể điện phân: 1 - bể, 2 - chất điện phân, 3 - cực dương, 4 - cực âm, 5 - nguồn điện
Điện cực có thể là bất kỳ vật liệu nào dẫn dòng điện. Kim loại và hợp kim được sử dụng chủ yếu; các điện cực phi kim loại có thể là, ví dụ, thanh than chì (hoặc cacbon). Ít phổ biến hơn, chất lỏng được sử dụng làm điện cực. Điện cực tích điện dương là cực dương. Một điện cực tích điện âm là cực âm. Trong quá trình điện phân, cực dương bị oxy hóa (hòa tan) và cực âm bị khử. Đó là lý do tại sao cực dương phải được sử dụng sao cho sự hòa tan của nó không ảnh hưởng đến quá trình hóa học xảy ra trong dung dịch hoặc tan chảy. Cực dương như vậy được gọi là điện cực trơ. Bạn có thể sử dụng than chì (cacbon) hoặc bạch kim làm cực dương trơ. Bạn có thể sử dụng một tấm kim loại làm cực âm (nó sẽ không bị hòa tan). Đồng, đồng thau, carbon (hoặc than chì), kẽm, sắt, nhôm, thép không gỉ đều phù hợp.
Ví dụ về điện phân nóng chảy:
Ví dụ về điện phân dung dịch muối:
(Các anion Cl? bị oxy hóa ở cực dương chứ không phải các phân tử nước oxy O? II, vì độ âm điện của clo nhỏ hơn oxy, và do đó clo dễ nhường electron hơn oxy)
Quá trình điện phân nước luôn được thực hiện với sự có mặt của chất điện phân trơ (để tăng tính dẫn điện của chất điện phân rất yếu - nước):
Tùy thuộc vào chất điện phân trơ mà quá trình điện phân được thực hiện trong môi trường trung tính, axit hoặc kiềm. Khi chọn chất điện phân trơ, cần phải tính đến các cation kim loại là chất khử điển hình (ví dụ Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+), không bao giờ bị khử ở cực âm trong dung dịch nước. Dung dịch và anion oxy O?II của axit oxoaxit không bao giờ bị oxy hóa ở cực dương với nguyên tố có mức độ oxy hóa cao nhất (ví dụ ClO4?, SO42?, NO3?, PO43?, CO32?, SiO44?, MnO4?), thay vào đó nước bị oxy hóa.
Điện phân bao gồm hai quá trình: sự di chuyển của các hạt phản ứng dưới tác dụng của điện trường đến bề mặt điện cực và sự truyền điện tích từ hạt sang điện cực hoặc từ điện cực sang hạt. Sự di chuyển của các ion được xác định bởi độ linh động và số lần vận chuyển của chúng. Theo quy luật, quá trình chuyển một số điện tích được thực hiện dưới dạng một chuỗi các phản ứng một electron, nghĩa là theo từng giai đoạn, với sự hình thành các hạt trung gian (ion hoặc gốc), đôi khi tồn tại trong một thời gian trên điện cực ở trạng thái hấp phụ.
Tốc độ phản ứng điện cực phụ thuộc vào:
thành phần chất điện phân
nồng độ chất điện giải
vật liệu điện cực
thế điện cực
nhiệt độ
điều kiện thủy động lực.
Mật độ dòng điện là thước đo tốc độ phản ứng. Đây là một vectơ vật lý, mô-đun của nó được xác định bằng tỷ số giữa cường độ dòng điện (số lượng điện tích truyền trên một đơn vị thời gian) trong dây dẫn và diện tích mặt cắt ngang.
Định luật điện phân Faraday là các mối quan hệ định lượng dựa trên các nghiên cứu điện hóa và giúp xác định khối lượng sản phẩm hình thành trong quá trình điện phân. Ở dạng tổng quát nhất, các định luật được xây dựng như sau:
)Định luật điện phân đầu tiên của Faraday: khối lượng của một chất lắng đọng trên điện cực trong quá trình điện phân tỷ lệ thuận với lượng điện truyền sang điện cực này. Khi nói đến lượng điện, chúng tôi muốn nói đến điện tích, thường được đo bằng coulomb.
2)Định luật điện phân thứ hai của Faraday: đối với một lượng điện (điện tích) nhất định, khối lượng của một nguyên tố hóa học lắng đọng trên điện cực tỷ lệ thuận với khối lượng tương đương của nguyên tố đó. Khối lượng tương đương của một chất là khối lượng mol của nó chia cho một số nguyên, tùy thuộc vào phản ứng hóa học mà chất đó tham gia.
Ở dạng toán học, định luật Faraday có thể được biểu diễn như sau:
trong đó m là khối lượng của chất lắng đọng trên điện cực tính bằng gam, là tổng điện tích truyền qua chất đó = 96.485,33(83) C mol?1 là hằng số Faraday, là khối lượng mol của chất đó (Ví dụ: mol khối lượng nước H2O = 18 g/mol), là số hóa trị của các ion của một chất (số electron trên mỗi ion).
Lưu ý rằng M/z là khối lượng tương đương của chất lắng đọng.
Đối với định luật Faraday thứ nhất, M, F và z là các hằng số nên giá trị của Q càng lớn thì giá trị của m sẽ càng lớn.
Đối với định luật thứ hai của Faraday, Q, F và z là các hằng số, do đó giá trị M/z (khối lượng tương đương) càng lớn thì giá trị m sẽ càng lớn.
Trong trường hợp đơn giản nhất, điện phân một chiều dẫn đến:
Trong trường hợp phức tạp hơn của dòng điện xoay chiều, tổng điện tích Q của dòng điện I( ?) được tổng hợp theo thời gian? :
trong đó t là tổng thời gian điện phân.
Trong công nghiệp, quá trình điện phân được thực hiện trên các thiết bị đặc biệt - máy điện phân.
Sản xuất clo công nghiệp
Hiện nay, clo chủ yếu được sản xuất bằng phương pháp điện phân dung dịch nước, cụ thể là một trong
Nguyên liệu để sản xuất điện phân clo chủ yếu là dung dịch muối ăn NaCl, thu được bằng cách hòa tan muối rắn hoặc nước muối tự nhiên. Có ba loại mỏ muối: muối hóa thạch (khoảng 99% trữ lượng); hồ muối có trầm tích đáy muối tự lắng (0,77%); phần còn lại là những phân chia ngầm. Dung dịch muối ăn, bất kể phương pháp điều chế nào, đều chứa tạp chất làm suy yếu quá trình điện phân. Đặc biệt không thuận lợi trong quá trình điện phân bằng cực âm rắn là các cation canxi Ca2+, Mg2+ và SO42-, và trong quá trình điện phân bằng cực âm lỏng - tạp chất của các hợp chất chứa kim loại nặng, như crom, vanadi, germani và molypden.
Muối tinh thể để điện phân clo phải có thành phần (%): natri clorua không nhỏ hơn 97,5; Mg2+ không quá 0,05; trầm tích không hòa tan không quá 0,5; Ca2+ không quá 0,4; K+ không quá 0,02; SO42 - không quá 0,84; độ ẩm không quá 5; tạp chất kim loại nặng (xác định bằng phép thử hỗn hống cm3 H2) không quá 0,3. Quá trình tinh chế nước muối được thực hiện bằng dung dịch soda (Na2CO3) và sữa vôi (dung dịch Ca(OH)2 trong nước). Ngoài việc tinh chế hóa học, các dung dịch còn được loại bỏ tạp chất cơ học bằng cách lắng và lọc.
Quá trình điện phân dung dịch muối ăn được thực hiện trong bể có cực âm bằng sắt (hoặc thép) rắn và có màng ngăn và màng, trong bể có cực âm thủy ngân lỏng. Máy điện phân công nghiệp dùng để trang bị cho các cửa hàng clo lớn hiện đại phải có hiệu suất cao, thiết kế đơn giản, nhỏ gọn, vận hành tin cậy và ổn định.
Quá trình điện phân diễn ra theo sơ đồ sau:
MeCl + H2O => MeOH + Cl2 + H2,
trong đó Me là kim loại kiềm.
Trong quá trình phân hủy điện hóa muối ăn trong máy điện phân có điện cực rắn, xảy ra các phản ứng ion bazơ, thuận nghịch và thuận nghịch sau:
sự phân ly của các phân tử muối ăn và nước (xảy ra trong chất điện phân)
NaCl-Na++Cl-
Oxy hóa ion clo (ở cực dương)
C1- - 2e- => C12
khử ion hydro và phân tử nước (ở cực âm)
Н+ - 2е- => Н2
Н2O - 2е - => Н2 + 2ОН-
Liên kết các ion thành phân tử natri hydroxit (trong chất điện phân)
Na+ + OH- - NaOH
Các sản phẩm hữu ích là natri hydroxit, clo và hydro. Tất cả chúng đều được loại bỏ khỏi máy điện phân một cách riêng biệt.
Cơm. 5.1. Sơ đồ máy điện phân màng
Khoang của máy điện phân có cực âm rắn (Hình 3) được chia bằng một lớp xốp
Các máy điện phân công nghiệp đầu tiên hoạt động ở chế độ hàng loạt. Các sản phẩm điện phân trong đó được ngăn cách bằng màng xi măng. Sau đó, các máy điện phân được tạo ra trong đó các vách ngăn hình chuông được sử dụng để tách các sản phẩm điện phân. Ở giai đoạn tiếp theo, máy điện phân có màng ngăn dòng chảy xuất hiện. Họ kết hợp nguyên lý dòng chảy ngược với việc sử dụng một màng ngăn cách được làm bằng bìa cứng amiăng. Tiếp theo, người ta phát hiện ra phương pháp sản xuất màng ngăn từ bột amiăng, mượn từ công nghệ của ngành giấy. Phương pháp này giúp phát triển các thiết kế máy điện phân cho tải dòng điện cao với cực âm ngón tay nhỏ gọn không thể tháo rời. Để tăng tuổi thọ của màng ngăn amiăng, người ta đề xuất đưa một số vật liệu tổng hợp vào thành phần của nó làm lớp phủ hoặc liên kết. Người ta cũng đề xuất chế tạo màng chắn hoàn toàn từ vật liệu tổng hợp mới. Có bằng chứng cho thấy các màng chắn tổng hợp amiăng kết hợp hoặc được sản xuất đặc biệt như vậy có tuổi thọ lên tới 500 ngày. Các màng trao đổi ion đặc biệt cũng đang được phát triển để có thể thu được xút tinh khiết có hàm lượng natri clorua rất thấp. Hoạt động của các màng như vậy dựa trên việc sử dụng các đặc tính chọn lọc của chúng để các ion khác nhau đi qua.
Trong các thiết kế ban đầu, các điểm tiếp xúc của dòng điện dẫn tới cực dương than chì đã được loại bỏ khỏi khoang điện phân ra bên ngoài. Sau đó, các phương pháp được phát triển để bảo vệ các bộ phận tiếp xúc của cực dương ngâm trong chất điện phân. Bằng cách sử dụng những kỹ thuật này, các máy điện phân công nghiệp có nguồn cung cấp dòng điện dưới cùng đã được tạo ra, trong đó các tiếp điểm cực dương được đặt trong khoang của máy điện phân. Ngày nay chúng được sử dụng ở mọi nơi để sản xuất clo và xút trên cực âm rắn.
Dòng dung dịch bão hòa muối ăn (nước muối tinh khiết) liên tục chảy vào không gian cực dương của máy điện phân màng. Kết quả của quá trình điện hóa, clo thoát ra ở cực dương do sự phân hủy của muối ăn và hydro thoát ra ở cực âm do sự phân hủy của nước. Clo và hydro được loại bỏ khỏi máy điện phân mà không cần trộn riêng. Trong trường hợp này, vùng gần cực âm được làm giàu bằng natri hydroxit. Một dung dịch từ vùng gần cực âm, được gọi là dung dịch điện phân, chứa muối ăn chưa phân hủy (khoảng một nửa lượng cung cấp nước muối) và natri hydroxit liên tục được loại bỏ khỏi máy điện phân. Ở giai đoạn tiếp theo, dung dịch điện phân được làm bay hơi và hàm lượng NaOH trong đó được điều chỉnh về mức 42-50% theo tiêu chuẩn. Muối ăn và natri sunfat kết tủa khi nồng độ natri hydroxit tăng.
Dung dịch NaOH được gạn khỏi các tinh thể và được chuyển dưới dạng thành phẩm đến kho hoặc công đoạn nấu chảy xút để thu được sản phẩm rắn. Muối ăn tinh thể (muối nghịch) được đưa trở lại điện phân, chuẩn bị cái gọi là nước muối nghịch. Để tránh sự tích tụ sunfat trong dung dịch, sunfat được loại bỏ khỏi nó trước khi chuẩn bị nước muối ngược. Sự mất muối ăn được bù đắp bằng cách thêm nước muối mới thu được bằng cách ngâm các lớp muối dưới lòng đất hoặc bằng cách hòa tan muối ăn rắn. Trước khi trộn với nước muối quay trở lại, nước muối tươi được làm sạch các huyền phù cơ học và một phần đáng kể các ion canxi và magie. Clo thu được được tách khỏi hơi nước, được nén và chuyển trực tiếp đến người tiêu dùng hoặc để hóa lỏng clo. Hydro được tách ra khỏi nước, được nén và chuyển đến người tiêu dùng.
Các phản ứng hóa học tương tự xảy ra trong máy điện phân màng cũng như trong máy điện phân màng. Thay vì màng xốp, màng cation được sử dụng (Hình 5).
Cơm. 5.2. Sơ đồ thiết bị điện phân màng
Màng ngăn chặn sự xâm nhập của các ion clo vào catholyte (chất điện phân trong không gian cathode), nhờ đó có thể thu được xút ăn da trực tiếp trong máy điện phân hầu như không cần muối, với nồng độ từ 30 đến 35%. Vì không cần phải tách muối nên sự bay hơi giúp sản xuất 50% xút thương mại dễ dàng hơn nhiều với chi phí vốn và năng lượng thấp hơn. Vì xút trong quá trình màng có nồng độ cao hơn nhiều nên niken đắt tiền được sử dụng làm cực âm.
Cơm. 5.3. Sơ đồ máy điện phân thủy ngân
Tổng phản ứng phân hủy muối ăn trong máy điện phân thủy ngân giống như trong máy điện phân màng:
NaCl+H2O => NaOH + 1/2Сl2+ 1/2Н2
Tuy nhiên, ở đây quá trình này diễn ra thành hai giai đoạn, mỗi giai đoạn ở một thiết bị riêng biệt: thiết bị điện phân và thiết bị phân hủy. Chúng được kết hợp về mặt cấu trúc với nhau và được gọi là bể điện phân, và đôi khi là máy điện phân thủy ngân.
Ở giai đoạn đầu tiên của quá trình - trong máy điện phân - quá trình phân hủy điện phân muối ăn diễn ra (dung dịch bão hòa của nó được cung cấp cho máy điện phân) để tạo ra clo ở cực dương và hỗn hống natri ở cực âm thủy ngân, theo phản ứng sau :
NaCl + nHg => l/2Cl2 + NaHgn
Chất phân hủy trải qua giai đoạn thứ hai của quá trình, trong đó, dưới tác dụng của nước, hỗn hống natri được chuyển thành natri hydroxit và thủy ngân:
NaHgn + H2O => NaOH +1/2H2+nHg
Trong số tất cả muối được đưa vào máy điện phân bằng nước muối, chỉ 15-20% lượng cung cấp sẽ tham gia phản ứng (2), phần muối còn lại cùng với nước rời khỏi máy điện phân ở dạng chloranolyte - dung dịch của muối ăn trong nước có chứa 250-270 kg/m3 NaCl bão hòa clo. “Hỗn hống mạnh” thoát ra từ thiết bị điện phân và nước được đưa vào thiết bị phân hủy.
Máy điện phân trong tất cả các thiết kế hiện có đều được chế tạo dưới dạng một rãnh thép dài và tương đối hẹp, hơi nghiêng, dọc theo đáy có một lớp hỗn hống mỏng chảy theo trọng lực, đó là cực âm, và chất anolyte chảy lên trên. Nước muối và hỗn hống yếu được nạp từ mép trên cùng của máy điện phân qua "túi đầu vào".
Hỗn hống mạnh chảy từ đầu dưới của máy điện phân qua "túi thoát". Clo và cloranolyte cùng nhau thoát ra ngoài qua một đường ống, cũng nằm ở đầu dưới của máy điện phân. Cực dương được treo phía trên toàn bộ gương dòng hỗn hống hoặc cực âm ở khoảng cách 3-5 mm so với cực âm. Mặt trên của máy điện phân được đậy bằng nắp.
Hai loại bộ phân hủy phổ biến: ngang và dọc. Đầu tiên được chế tạo dưới dạng máng nghiêng bằng thép có cùng chiều dài với máy điện phân. Một dòng hỗn hống chảy dọc theo đáy thiết bị phân hủy, được lắp đặt ở một góc nhỏ. Một vòi phân hủy làm bằng than chì được ngâm trong dòng chảy này. Nước chuyển động ngược dòng. Do sự phân hủy của hỗn hống, nước bị bão hòa chất ăn da. Dung dịch xút cùng với hydro rời khỏi thiết bị phân hủy qua một đường ống ở phía dưới, và hỗn hống hoặc thủy ngân kém chất lượng được bơm vào túi tế bào.
Ngoài máy điện phân, bộ phân hủy, túi và đường ống chuyển, bộ dụng cụ tắm điện phân còn có máy bơm thủy ngân. Hai loại máy bơm được sử dụng. Trong trường hợp bể được trang bị bể phân hủy thẳng đứng hoặc bể phân hủy được lắp đặt dưới máy điện phân thì sử dụng máy bơm ly tâm chìm thông thường hạ xuống bể phân hủy. Đối với các bồn tắm có lắp đặt bộ phân hủy bên cạnh thiết bị điện phân, hỗn hống được bơm bằng bơm quay hình nón loại ban đầu.
Tất cả các bộ phận thép của máy điện phân tiếp xúc với clo hoặc chloranolyte đều được bảo vệ bằng lớp phủ cao su lưu hóa (kéo dính) cấp độ đặc biệt. Lớp cao su bảo vệ không có khả năng chống chịu hoàn toàn. Theo thời gian, nó bị clo hóa và trở nên giòn và nứt do nhiệt độ. Định kỳ, lớp bảo vệ được đổi mới. Tất cả các bộ phận khác của bể điện phân: bộ phân hủy, máy bơm, thiết bị tràn đều được làm bằng thép không được bảo vệ, vì cả dung dịch hydro và xút đều không ăn mòn nó.
Hiện nay, cực dương than chì là loại phổ biến nhất trong các máy điện phân thủy ngân. Tuy nhiên, chúng đang được thay thế bởi ORTA.
6.Các biện pháp phòng ngừa an toàn trong sản xuất clo
và bảo vệ môi trường
Mối nguy hiểm đối với nhân viên sản xuất clo được xác định bởi độc tính cao của clo và thủy ngân, khả năng hình thành trong thiết bị hỗn hợp khí nổ của clo và hydro, hydro và không khí, cũng như dung dịch nitơ triclorua trong clo lỏng. , việc sử dụng trong sản xuất máy điện phân - thiết bị có điện thế tăng so với đất, tính chất của kiềm ăn da được tạo ra trong quá trình sản xuất này.
Hít phải không khí chứa 0,1 mg/l clo trong 30-60 phút sẽ nguy hiểm đến tính mạng. Hít phải không khí chứa hơn 0,001 mg/l clo sẽ gây kích ứng đường hô hấp. Nồng độ tối đa cho phép (MPC) của clo trong không khí khu dân cư: trung bình ngày 0,03 mg/m3, tối đa một lần 0,1 mg/m3, trong không khí khu vực làm việc của cơ sở công nghiệp là 1 mg/m3, mùi hôi ngưỡng cảm nhận 2 mg/m3. Ở nồng độ 3-6 mg/m3, có mùi đặc trưng, kích ứng (đỏ) mắt và màng nhầy mũi xảy ra, ở mức 15 mg/m3 - kích ứng vòm họng, ở mức 90 mg/m3 - các cơn ho dữ dội . Tiếp xúc với nồng độ 120 - 180 mg/m3 trong 30-60 phút sẽ nguy hiểm đến tính mạng, ở nồng độ 300 mg/m3 có thể tử vong, nồng độ 2500 mg/m3 gây tử vong trong vòng 5 phút, ở nồng độ 3000 mg/m3 gây tử vong xảy ra sau vài hơi thở. Nồng độ clo tối đa cho phép để lọc mặt nạ phòng độc công nghiệp và dân dụng là 2500 mg/m3.
Sự có mặt của clo trong không khí được xác định bằng các thiết bị trinh sát hóa học: VPKhR, PPKhR, PKhR-MV sử dụng ống chỉ thị IT-44 (màu hồng, ngưỡng nhạy 5 mg/m3), IT-45 (màu cam), máy hút AM- 5, AM-0055, AM-0059, NP-3M với ống chỉ thị clo, máy phân tích khí đa năng UG-2 với dải đo 0-80 mg/m3, máy dò khí "Kolion-701" trong dải 0- 20 mg/m3. Trong không gian mở - với thiết bị SIP "KORSAR-X". Trong nhà - với thiết bị SIP "VEGA-M". Để bảo vệ khỏi khí clo khi có sự cố hoặc tình huống khẩn cấp, tất cả mọi người trong phân xưởng phải có và sử dụng kịp thời mặt nạ phòng độc loại “B” hoặc “BKF” (trừ phân xưởng điện phân thủy ngân), cũng như quần áo bảo hộ: vải hoặc bộ đồ cao su, ủng cao su và găng tay. Hộp đựng mặt nạ phòng độc clo nên sơn màu vàng.
Thủy ngân độc hơn clo. Nồng độ tối đa cho phép của hơi của nó trong không khí là 0,00001 mg/l. Nó ảnh hưởng đến cơ thể con người thông qua đường hô hấp và tiếp xúc với da, cũng như qua tiếp xúc với các vật thể hỗn hợp. Hơi và bắn tung tóe của nó được hấp thụ (hấp thụ) bởi quần áo, da và răng. Đồng thời thủy ngân dễ dàng bay hơi ở nhiệt độ cao; có sẵn trong xưởng điện phân và nồng độ hơi của nó trong không khí vượt xa mức tối đa cho phép. Do đó, các xưởng điện phân có cực âm lỏng được trang bị hệ thống thông gió mạnh mẽ, trong quá trình hoạt động bình thường sẽ đảm bảo nồng độ hơi thủy ngân ở mức chấp nhận được trong không khí xưởng. Tuy nhiên, điều này là chưa đủ để vận hành an toàn. Cũng cần phải tuân thủ cái gọi là kỷ luật thủy ngân: tuân theo các quy tắc xử lý thủy ngân. Theo họ, trước khi bắt đầu công việc, các nhân viên sẽ đi qua trạm kiểm soát vệ sinh, tại khu vực sạch sẽ, họ để quần áo ở nhà và mặc đồ vải lanh mới giặt, đó là loại quần áo đặc biệt. Khi kết thúc ca làm việc, quần áo bên ngoài và khăn trải giường bẩn được để lại khu vực bẩn của phòng kiểm tra vệ sinh, công nhân tắm rửa, đánh răng và mặc đồ gia dụng vào khu vực sạch sẽ của phòng kiểm tra vệ sinh.
Ở những xưởng làm việc với clo và thủy ngân nên sử dụng mặt nạ phòng độc hiệu G (hộp mặt nạ phòng độc được sơn màu đen và vàng) và găng tay cao su. Nội quy “kỷ luật thủy ngân” quy định làm việc với thủy ngân và hỗn hợp. bề mặt chỉ nên được thực hiện dưới một lớp nước; Thủy ngân tràn ra phải được rửa ngay xuống cống nơi có bẫy thủy ngân.
Môi trường đang bị đe dọa bởi sự phát thải khí clo và hơi thủy ngân vào khí quyển, thải muối thủy ngân và giọt thủy ngân, các hợp chất chứa clo hoạt tính vào nước thải và ngộ độc đất do bùn thủy ngân. Clo xâm nhập vào khí quyển khi xảy ra tai nạn, cùng với khí thải thông gió và khí thải từ nhiều thiết bị khác nhau. Hơi thủy ngân được thực hiện với không khí từ hệ thống thông gió. Định mức hàm lượng clo trong không khí khi thải vào khí quyển là 0,03 mg/m3. Nồng độ này có thể đạt được nếu sử dụng phương pháp rửa khí thải nhiều giai đoạn bằng kiềm. Chỉ tiêu hàm lượng thủy ngân trong không khí khi thải ra khí quyển là 0,0003 mg/m3 và trong nước thải khi thải vào nguồn nước là 4 mg/m3.
Trung hòa clo bằng các dung dịch sau:
sữa vôi, trong đó 1 phần trọng lượng của vôi tôi được đổ vào 3 phần nước, trộn đều, sau đó đổ dung dịch vôi lên trên (ví dụ: 10 kg vôi tôi + 30 lít nước);
Dung dịch tro soda 5%, trong đó 2 phần tro soda được hòa tan bằng cách trộn với 18 phần nước (ví dụ: 5 kg tro soda + 95 lít nước);
Dung dịch xút 5%, trong đó 2 phần xút được hòa tan theo trọng lượng bằng cách trộn với 18 phần nước (ví dụ: 5 kg xút + 95 lít nước).
Nếu khí clo bị rò rỉ, nước sẽ được phun để dập tắt hơi. Tỷ lệ tiêu thụ nước không được tiêu chuẩn hóa.
Khi clo lỏng tràn ra, khu vực tràn được rào lại bằng thành lũy bằng đất và đổ đầy sữa vôi, dung dịch tro soda, xút hoặc nước. Để trung hòa 1 tấn clo lỏng cần 0,6-0,9 tấn nước hoặc 0,5-0,8 tấn dung dịch. Để trung hòa 1 tấn clo lỏng cần 22-25 tấn dung dịch hoặc 333-500 tấn nước.
Để phun nước hoặc dung dịch, xe tưới nước và cứu hỏa, trạm nạp tự động (AT, PM-130, ARS-14, ARS-15), cũng như vòi phun nước và hệ thống đặc biệt có sẵn tại các cơ sở nguy hiểm về mặt hóa học, được sử dụng.
Phần kết luận
Vì khối lượng clo thu được bằng các phương pháp trong phòng thí nghiệm là không đáng kể so với nhu cầu ngày càng tăng đối với sản phẩm này nên việc tiến hành phân tích so sánh về chúng là vô nghĩa.
Trong số các phương pháp sản xuất điện hóa, dễ dàng và thuận tiện nhất là điện phân bằng cực âm lỏng (thủy ngân), nhưng phương pháp này không phải là không có nhược điểm. Nó gây ra thiệt hại đáng kể về môi trường thông qua sự bay hơi và rò rỉ thủy ngân kim loại và khí clo.
Máy điện phân có cực âm rắn loại bỏ nguy cơ ô nhiễm môi trường do thủy ngân. Khi lựa chọn giữa máy điện phân màng và màng cho các cơ sở sản xuất mới, tốt nhất nên sử dụng loại sau vì chúng tiết kiệm hơn và mang lại cơ hội thu được sản phẩm cuối cùng chất lượng cao hơn.
Thư mục
1.Zaretsky S. A., Suchkov V. N., Zhivotinsky P. B. Công nghệ điện hóa của các chất vô cơ và nguồn dòng hóa học: Sách giáo khoa dành cho sinh viên trường kỹ thuật. M..: Cao hơn. Trường học, 1980. 423 tr.
2.Mazanko A.F., Kamaryan G.M., Romashin O.P. Điện phân màng công nghiệp. M.: Nhà xuất bản "Hóa học", 1989. 240 tr.
.Pozin M.E. Công nghệ muối khoáng (phân bón, thuốc trừ sâu, muối công nghiệp, oxit và axit), phần 1, ed. Thứ 4, vòng quay. L., Nhà xuất bản "Hóa học", 1974. 792 tr.
.Fioshin M. Ya., Pavlov V. N. Điện phân trong hóa học vô cơ. M.: Nhà xuất bản "Nauka", 1976. 106 tr.
.Yakimenko L. M. Sản xuất clo, xút và các sản phẩm clo vô cơ. M.: Nhà xuất bản "Hóa học", 1974. 600 tr.
Nguồn Internet
6.Quy tắc an toàn trong sản xuất, bảo quản, vận chuyển và sử dụng clo // URL: #"justify">7. Các chất nguy hiểm về mặt hóa học khẩn cấp // URL: #"justify">. Clo: ứng dụng // URL: #"justify">.
(theo Pauling)
/cm³
clo (χλωρός - màu xanh lá cây) - một nguyên tố thuộc phân nhóm chính của nhóm thứ bảy, chu kỳ thứ ba trong hệ thống tuần hoàn các nguyên tố hóa học của D.I. Mendeleev, với số nguyên tử 17. Ký hiệu là ký hiệu Cl (lat. Chlorum). Phi kim loại có hoạt tính hóa học. Nó là một phần của nhóm halogen (ban đầu tên “halogen” được nhà hóa học người Đức Schweiger sử dụng cho clo [theo nghĩa đen, “halogen” được dịch là muối), nhưng nó không được ưa chuộng và sau đó trở nên phổ biến đối với nhóm VII của các nguyên tố, trong đó có clo).
Chất clo đơn giản (số CAS: 7782-50-5) trong điều kiện bình thường là một loại khí độc có màu xanh vàng, có mùi hăng. Phân tử clo diatomic (công thức Cl2).
Sơ đồ nguyên tử clo
Clo lần đầu tiên được Scheele thu được vào năm 1772, người đã mô tả sự giải phóng nó trong quá trình tương tác giữa pyrolusite với axit clohydric trong chuyên luận của ông về pyrolusite:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Scheele lưu ý đến mùi của clo, tương tự như mùi của nước cường toan, khả năng phản ứng với vàng và chu sa cũng như đặc tính tẩy trắng của nó.
Tuy nhiên, Scheele, theo lý thuyết nhiên tố chiếm ưu thế trong hóa học thời bấy giờ, cho rằng clo là axit clohydric khử phologistic, tức là oxit của axit clohydric. Berthollet và Lavoisier cho rằng clo là một oxit của nguyên tố muria, nhưng nỗ lực cô lập nó vẫn không thành công cho đến khi Davy có công, người đã phân hủy muối ăn thành natri và clo bằng điện phân.
Phân bố trong tự nhiên
Trong tự nhiên clo có hai đồng vị là 35 Cl và 37 Cl. Trong vỏ trái đất, clo là halogen phổ biến nhất. Clo hoạt động rất mạnh - nó kết hợp trực tiếp với hầu hết các nguyên tố trong bảng tuần hoàn. Vì vậy, trong tự nhiên nó chỉ được tìm thấy ở dạng hợp chất trong các khoáng vật: halit NaCl, sylvit KCl, sylvinite KCl NaCl, bischofite MgCl 2 6H2O, Carnallite KCl MgCl 2 6H 2 O, kainite KCl MgSO 4 3H 2 O. Lớn nhất trữ lượng clo có trong muối của nước biển và đại dương.
Clo chiếm 0,025% tổng số nguyên tử trong vỏ trái đất, số lượng clo là 0,19% và cơ thể con người chứa 0,25% ion clo theo khối lượng. Trong cơ thể người và động vật, clo được tìm thấy chủ yếu trong dịch gian bào (bao gồm cả máu) và đóng vai trò quan trọng trong việc điều hòa các quá trình thẩm thấu, cũng như trong các quá trình liên quan đến hoạt động của các tế bào thần kinh.
Thành phần đồng vị
Trong tự nhiên có 2 đồng vị ổn định của clo: có số khối là 35 và 37. Tỷ lệ hàm lượng của chúng lần lượt là 75,78% và 24,22%.
| Đồng vị | Khối lượng tương đối, a.m.u. | Nửa đời | Loại phân rã | Quay hạt nhân |
|---|---|---|---|---|
| 35Cl | 34.968852721 | Ổn định | — | 3/2 |
| 36Cl | 35.9683069 | 301000 năm | β phân rã trong 36 Ar | 0 |
| 37Cl | 36.96590262 | Ổn định | — | 3/2 |
| 38Cl | 37.9680106 | 37,2 phút | β phân rã trong 38 Ar | 2 |
| 39 Cl | 38.968009 | 55,6 phút | β phân rã thành 39 Ar | 3/2 |
| 40Cl | 39.97042 | 1,38 phút | β phân rã trong 40 Ar | 2 |
| 41Cl | 40.9707 | 34 giây | β phân rã trong 41 Ar | |
| 42Cl | 41.9732 | 46,8 giây | β phân rã trong 42 Ar | |
| 43 Cl | 42.9742 | 3,3 giây | β-phân rã trong 43 Ar |
Tính chất vật lý và hóa lý
Trong điều kiện bình thường, clo là chất khí màu vàng lục, có mùi ngột ngạt. Một số tính chất vật lý của nó được trình bày trong bảng.
Một số tính chất vật lý của clo
| Tài sản | Nghĩa |
|---|---|
| Nhiệt độ sôi | −34 °C |
| Nhiệt độ nóng chảy | −101 °C |
| nhiệt độ phân hủy (sự phân ly thành nguyên tử) |
~1400°С |
| Mật độ (khí, n.s.) | 3,214 g/l |
| Ái lực điện tử của nguyên tử | 3,65 eV |
| Năng lượng ion hóa thứ nhất | 12,97 eV |
| Công suất nhiệt (298 K, gas) | 34,94 (J/mol K) |
| Nhiệt độ nguy hiểm | 144°C |
| Áp lực tới hạn | 76 atm |
| Entanpy tiêu chuẩn của sự hình thành (298 K, khí) | 0 (kJ/mol) |
| Entropy tiêu chuẩn của sự hình thành (298 K, khí) | 222,9 (J/mol K) |
| Entanpi nóng chảy | 6,406 (kJ/mol) |
| Entanpy sôi | 20,41 (kJ/mol) |
Khi nguội, clo chuyển sang thể lỏng ở nhiệt độ khoảng 239 K, sau đó ở nhiệt độ dưới 113 K nó kết tinh thành mạng trực thoi có nhóm không gian. Cmca và các tham số a=6,29 b=4,50, c=8,21. Dưới 100 K, sự biến đổi trực thoi của clo tinh thể trở thành tứ giác, có nhóm không gian P4 2/ncm và các tham số mạng a=8,56 và c=6,12.
độ hòa tan
| dung môi | Độ hòa tan g/100 g |
|---|---|
| Benzen | Hãy hòa tan |
| Nước (0°C) | 1,48 |
| Nước (20°C) | 0,96 |
| Nước (25°C) | 0,65 |
| Nước (40°C) | 0,46 |
| Nước (60°C) | 0,38 |
| Nước (80°C) | 0,22 |
| Cacbon tetraclorua (0°C) | 31,4 |
| Cacbon tetraclorua (19°C) | 17,61 |
| Cacbon tetraclorua (40°C) | 11 |
| Cloroform | Hòa tan tốt |
| TiCl 4, SiCl 4, SnCl 4 | Hãy hòa tan |
Trong ánh sáng hoặc khi đun nóng, nó phản ứng tích cực (đôi khi gây nổ) với hydro theo cơ chế triệt để. Hỗn hợp clo và hydro, chứa từ 5,8 đến 88,3% hydro, phát nổ khi chiếu xạ tạo thành hydro clorua. Hỗn hợp clo và hydro ở nồng độ nhỏ cháy với ngọn lửa không màu hoặc màu vàng lục. Nhiệt độ tối đa của ngọn lửa hydro-clo 2200 ° C:
Cl 2 + H 2 → 2HCl 5Cl 2 + 2P → 2PCl 5 2S + Cl 2 → S 2 Cl 2 Cl 2 + 3F 2 (ví dụ) → 2ClF 3
Các tài sản khác
Cl 2 + CO → COCl 2Khi hòa tan trong nước hoặc kiềm, clo bị biến tính, tạo thành axit hypochlorous (và khi đun nóng, perchloric) và axit clohydric, hoặc muối của chúng:
Cl 2 + H 2 O → HCl + HClO 3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O Cl 2 + Ca(OH) 2 → CaCl(OCl) + H 2 O 4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
Tính oxi hóa của clo
Cl 2 + H 2 S → 2HCl + SPhản ứng với chất hữu cơ
CH 3 -CH 3 + Cl 2 → C 2 H 6-x Cl x + HClGắn với các hợp chất chưa bão hòa thông qua nhiều liên kết:
CH 2 =CH 2 + Cl 2 → Cl-CH 2 -CH 2 -Cl
Các hợp chất thơm thay thế nguyên tử hydro bằng clo với sự có mặt của chất xúc tác (ví dụ AlCl 3 hoặc FeCl 3):
C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl
Các phương pháp sản xuất clo
Phương pháp công nghiệp
Ban đầu, phương pháp công nghiệp sản xuất clo dựa trên phương pháp Scheele, nghĩa là phản ứng của pyrolusite với axit clohydric:
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O 2NaCl + 2H 2 O → H 2 + Cl 2 + 2NaOH Cực dương: 2Cl - - 2е - → Cl 2 0 Cực âm: 2H 2 O + 2e - → H 2 + 2OH-
Vì quá trình điện phân nước xảy ra song song với quá trình điện phân natri clorua nên phương trình tổng thể có thể được biểu diễn như sau:
1,80 NaCl + 0,50 H 2 O → 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2
Ba biến thể của phương pháp điện hóa để sản xuất clo được sử dụng. Hai trong số đó là điện phân bằng catốt rắn: phương pháp màng và màng, thứ ba là điện phân bằng catốt lỏng (phương pháp sản xuất thủy ngân). Trong số các phương pháp sản xuất điện hóa, phương pháp đơn giản và thuận tiện nhất là điện phân bằng catốt thủy ngân, tuy nhiên phương pháp này gây ra tác hại đáng kể cho môi trường do bay hơi và rò rỉ thủy ngân kim loại.
Phương pháp màng ngăn với cathode rắn
Khoang máy điện phân được chia bởi một vách ngăn amiăng xốp - một màng ngăn - thành các không gian cực âm và cực dương, nơi lần lượt đặt cực âm và cực dương của máy điện phân. Do đó, máy điện phân như vậy thường được gọi là màng ngăn và phương pháp sản xuất là điện phân màng. Một dòng anolyte bão hòa (dung dịch NaCl) liên tục chảy vào không gian anode của máy điện phân màng. Kết quả của quá trình điện hóa, clo thoát ra ở cực dương do sự phân hủy của halit và hydro thoát ra ở cực âm do sự phân hủy của nước. Trong trường hợp này, vùng gần cực âm được làm giàu bằng natri hydroxit.
Phương pháp màng với cực âm rắn
Phương pháp màng về cơ bản tương tự như phương pháp màng ngăn, nhưng không gian cực dương và cực âm được ngăn cách bằng màng polyme trao đổi cation. Phương pháp sản xuất màng hiệu quả hơn phương pháp màng ngăn nhưng khó sử dụng hơn.
Phương pháp thủy ngân với cực âm lỏng
Quá trình này được thực hiện trong bể điện phân, bao gồm máy điện phân, thiết bị phân hủy và bơm thủy ngân, được kết nối với nhau bằng thông tin liên lạc. Trong bể điện phân, thủy ngân tuần hoàn dưới tác dụng của bơm thủy ngân, đi qua thiết bị điện phân và thiết bị phân hủy. Cực âm của máy điện phân là dòng thủy ngân. Cực dương - than chì hoặc độ mài mòn thấp. Cùng với thủy ngân, dòng anolyte - dung dịch natri clorua - liên tục chảy qua máy điện phân. Do sự phân hủy điện hóa của clorua, các phân tử clo được hình thành ở cực dương và ở cực âm, natri giải phóng hòa tan trong thủy ngân tạo thành hỗn hống.
Phương pháp thí nghiệm
Trong phòng thí nghiệm, để sản xuất clo, các quy trình dựa trên quá trình oxy hóa hydro clorua bằng các tác nhân oxy hóa mạnh (ví dụ, oxit mangan (IV), kali permanganat, kali dicromat) thường được sử dụng:
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 5Cl 2 +8H 2 O K 2 Cr 2 O 7 + 14HCl → 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
Lưu trữ clo
Clo sinh ra được lưu trữ trong các “bể” đặc biệt hoặc được bơm vào các bình thép áp suất cao. Xi lanh chứa clo lỏng dưới áp suất có màu đặc biệt - màu đầm lầy. Cần lưu ý rằng trong quá trình sử dụng bình chứa clo kéo dài, nitơ triclorua cực kỳ dễ nổ sẽ tích tụ trong đó, và do đó, thỉnh thoảng, bình chứa clo phải được rửa và làm sạch định kỳ bằng nitơ clorua.
Tiêu chuẩn chất lượng clo
Theo GOST 6718-93 “Clo lỏng. Thông số kỹ thuật" các loại clo sau đây được sản xuất
Ứng dụng
Clo được sử dụng trong nhiều ngành công nghiệp, khoa học và nhu cầu trong gia đình:
- Trong sản xuất polyvinyl clorua, các hợp chất nhựa, cao su tổng hợp, từ đó họ tạo ra: dây cách điện, khung cửa sổ, vật liệu đóng gói, quần áo và giày dép, vải sơn và hồ sơ, vecni, thiết bị và nhựa xốp, đồ chơi, bộ phận dụng cụ, vật liệu xây dựng. Polyvinyl clorua được sản xuất bằng phản ứng trùng hợp vinyl clorua, ngày nay thường được sản xuất từ ethylene bằng phương pháp cân bằng clo thông qua 1,2-dichloroethane trung gian.
- Đặc tính tẩy trắng của clo đã được biết đến từ lâu, mặc dù bản thân clo không phải là chất “tẩy trắng” mà là oxy nguyên tử, được hình thành trong quá trình phân hủy axit hypochlorous: Cl 2 + H 2 O → HCl + HClO → 2HCl + O.. Phương pháp tẩy trắng vải, giấy, bìa cứng này đã được sử dụng từ nhiều thế kỷ nay.
- Sản xuất thuốc trừ sâu clo hữu cơ - chất diệt côn trùng gây hại cho cây trồng nhưng an toàn cho cây trồng. Một phần đáng kể clo sinh ra được tiêu thụ để thu được các sản phẩm bảo vệ thực vật. Một trong những loại thuốc trừ sâu quan trọng nhất là hexachlorocyclohexane (thường được gọi là hexachlorane). Chất này lần đầu tiên được Faraday tổng hợp vào năm 1825, nhưng nó chỉ được ứng dụng thực tế hơn 100 năm sau - vào những năm 30 của thế kỷ chúng ta.
- Nó được sử dụng làm tác nhân chiến tranh hóa học, cũng như để sản xuất các tác nhân chiến tranh hóa học khác: khí mù tạt, phosgene.
- Để khử trùng nước - clo hóa. Phương pháp khử trùng nước uống phổ biến nhất; dựa trên khả năng của clo tự do và các hợp chất của nó trong việc ức chế hệ thống enzyme của vi sinh vật xúc tác cho quá trình oxy hóa khử. Để khử trùng nước uống, những chất sau đây được sử dụng: clo, clo dioxide, chloramine và thuốc tẩy. SanPiN 2.1.4.1074-01 thiết lập các giới hạn (hành lang) sau đây về hàm lượng clo dư tự do cho phép trong nước uống của nguồn cấp nước tập trung 0,3 - 0,5 mg/l. Một số nhà khoa học và thậm chí cả các chính trị gia ở Nga chỉ trích chính khái niệm khử trùng bằng clo trong nước máy, nhưng không thể đưa ra giải pháp thay thế cho hậu quả khử trùng của hợp chất clo. Các vật liệu làm ống nước tương tác khác với nước máy được khử trùng bằng clo. Clo tự do trong nước máy làm giảm đáng kể tuổi thọ của đường ống làm từ polyolefin: nhiều loại ống polyetylen, bao gồm cả polyetylen liên kết ngang, loại lớn được gọi là PEX (PE-X). Tại Hoa Kỳ, để kiểm soát việc tiếp nhận các đường ống làm bằng vật liệu polyme để sử dụng trong hệ thống cấp nước có nước clo, họ buộc phải áp dụng 3 tiêu chuẩn: ASTM F2023 liên quan đến đường ống, màng và cơ xương. Các kênh này thực hiện các chức năng quan trọng trong việc điều chỉnh thể tích dịch, vận chuyển ion xuyên biểu mô và ổn định điện thế màng và tham gia vào việc duy trì độ pH của tế bào. Clo tích tụ trong mô nội tạng, da và cơ xương. Clo được hấp thu chủ yếu ở ruột già. Sự hấp thu và bài tiết clo có liên quan chặt chẽ với các ion natri và bicarbonate, và ở mức độ thấp hơn với hoạt động của Mineralocorticoid và Na + /K + -ATPase. 10-15% tổng lượng clo tích tụ trong tế bào, trong đó 1/3 đến 1/2 nằm trong hồng cầu. Khoảng 85% clo được tìm thấy trong không gian ngoại bào. Clo được bài tiết ra khỏi cơ thể chủ yếu qua nước tiểu (90-95%), phân (4-8%) và qua da (lên tới 2%). Sự bài tiết clo có liên quan đến các ion natri và kali và tương hỗ với HCO 3 - (cân bằng axit-bazơ).
Một người tiêu thụ 5-10 g NaCl mỗi ngày. Nhu cầu clo tối thiểu của con người là khoảng 800 mg mỗi ngày. Trẻ nhận được lượng clo cần thiết qua sữa mẹ, sữa có chứa 11 mmol/l clo. NaCl cần thiết cho việc sản xuất axit clohydric trong dạ dày, giúp thúc đẩy quá trình tiêu hóa và tiêu diệt vi khuẩn gây bệnh. Hiện nay, sự liên quan của clo trong việc gây ra một số bệnh ở người chưa được nghiên cứu kỹ, chủ yếu là do số lượng nghiên cứu còn ít. Chỉ cần nói rằng ngay cả những khuyến nghị về lượng clo tiêu thụ hàng ngày cũng chưa được phát triển. Mô cơ của con người chứa 0,20-0,52% clo, mô xương - 0,09%; trong máu - 2,89 g/l. Cơ thể người trung bình (trọng lượng cơ thể 70 kg) chứa 95 g clo. Mỗi ngày một người nhận được 3-6 g clo từ thực phẩm, nhiều hơn mức cần thiết cho nguyên tố này.
Ion clo rất cần thiết cho cây trồng. Clo tham gia vào quá trình chuyển hóa năng lượng ở thực vật bằng cách kích hoạt quá trình phosphoryl oxy hóa. Nó cần thiết cho sự hình thành oxy trong quá trình quang hợp bởi lục lạp bị cô lập và kích thích các quá trình quang hợp phụ trợ, chủ yếu là những quá trình liên quan đến tích lũy năng lượng. Clo có tác dụng tích cực trong việc hấp thụ các hợp chất oxy, kali, canxi và magie của rễ. Nồng độ ion clo quá mức trong thực vật cũng có thể có mặt tiêu cực, chẳng hạn như làm giảm hàm lượng chất diệp lục, giảm hoạt động quang hợp, làm chậm sự sinh trưởng và phát triển của cây Baskunchak clo). Clo là một trong những tác nhân hóa học đầu tiên được sử dụng
— Sử dụng các thiết bị phân tích thí nghiệm, điện cực thí nghiệm và công nghiệp, đặc biệt: Điện cực tham chiếu ESR-10101 phân tích hàm lượng Cl- và K+.
Truy vấn clo, chúng tôi được tìm thấy bằng truy vấn clo
Tương tác, ngộ độc, nước, phản ứng và sản sinh clo
- oxit
- giải pháp
- axit
- kết nối
- của cải
- sự định nghĩa
- dioxit
- công thức
- cân nặng
- tích cực
- chất lỏng
- chất
- ứng dụng
- hoạt động
- trạng thái oxy hóa
- hydroxit