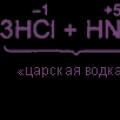2.1. Ngôn ngữ hóa học và các bộ phận của nó
Nhân loại sử dụng nhiều ngôn ngữ khác nhau. Ngoại trừ ngôn ngữ tự nhiên(Tiếng Nhật, tiếng Anh, tiếng Nga - tổng cộng hơn 2,5 nghìn), cũng có ngôn ngữ nhân tạo, ví dụ: Esperanto. Trong số các ngôn ngữ nhân tạo có ngôn ngữ nhiều khoa học. Vì vậy, trong hóa học họ sử dụng chính mình, ngôn ngữ hóa học.
Ngôn ngữ hóa học– một hệ thống các ký hiệu và khái niệm được thiết kế để ghi lại và truyền tải thông tin hóa học một cách ngắn gọn, cô đọng và trực quan.
Một thông điệp được viết bằng hầu hết các ngôn ngữ tự nhiên được chia thành câu, câu thành từ và từ thành chữ cái. Nếu gọi câu, từ và chữ cái là các bộ phận của ngôn ngữ thì chúng ta có thể xác định được các bộ phận tương tự trong ngôn ngữ hóa học (Bảng 2).
Ban 2.Các phần của ngôn ngữ hóa học
Không thể thành thạo bất kỳ ngôn ngữ nào ngay lập tức, điều này cũng áp dụng cho ngôn ngữ hóa học. Vì vậy, hiện tại bạn sẽ chỉ làm quen với những điều cơ bản của ngôn ngữ này: học một số “chữ cái”, học cách hiểu nghĩa của “từ” và “câu”. Ở cuối chương này bạn sẽ được giới thiệu tên chất hóa học là một phần không thể thiếu của ngôn ngữ hóa học. Khi bạn học hóa học, kiến thức về ngôn ngữ hóa học của bạn sẽ được mở rộng và đào sâu hơn.
NGÔN NGỮ HÓA CHẤT.
1. Bạn biết những ngôn ngữ nhân tạo nào (ngoài những ngôn ngữ được đề cập trong sách giáo khoa)?
2. Ngôn ngữ tự nhiên khác ngôn ngữ nhân tạo như thế nào?
3. Bạn có nghĩ có thể mô tả các hiện tượng hóa học mà không cần sử dụng ngôn ngữ hóa học không? Nếu không, tai sao không? Nếu vậy, những ưu điểm và nhược điểm của cách mô tả như vậy là gì?
2.2. Ký hiệu nguyên tố hóa học
Ký hiệu của một nguyên tố hóa học tượng trưng cho chính nguyên tố đó hoặc một nguyên tử của nguyên tố đó.
Mỗi ký hiệu như vậy là tên Latin viết tắt của một nguyên tố hóa học, bao gồm một hoặc hai chữ cái trong bảng chữ cái Latinh (đối với bảng chữ cái Latinh, xem Phụ lục 1). Biểu tượng được viết bằng chữ in hoa. Các ký hiệu, cũng như tên tiếng Nga và tiếng Latin của một số nguyên tố, được đưa ra trong Bảng 3. Thông tin về nguồn gốc của tên Latin cũng được đưa ra ở đó. Không có quy tắc chung cho việc phát âm các ký hiệu, do đó Bảng 3 cũng chỉ ra cách “đọc” ký hiệu, tức là ký hiệu này được đọc như thế nào trong công thức hóa học.
Không thể thay thế tên của một nguyên tố bằng ký hiệu trong lời nói, nhưng trong văn bản viết tay hoặc in thì điều này được phép, nhưng không được khuyến khích. Hiện nay, 110 nguyên tố hóa học đã được biết đến, 109 trong số đó có tên và ký hiệu được Quốc tế phê duyệt Liên minh Hóa học thuần túy và ứng dụng (IUPAC).
Bảng 3 chỉ cung cấp thông tin về 33 yếu tố. Đây là những yếu tố mà bạn sẽ gặp đầu tiên khi học hóa học. Tên tiếng Nga (theo thứ tự bảng chữ cái) và ký hiệu của tất cả các nguyên tố được đưa ra trong Phụ lục 2.
Bàn số 3.Tên và ký hiệu của một số nguyên tố hóa học
Tên |
||||
Latin |
Viết |
|||
| - | Viết |
Nguồn gốc |
- | - |
| Nitơ | N itrogeni | Từ tiếng Hy Lạp "sinh ra muối tiêu" | "vi" | |
| Nhôm | Al uminium | Từ lat. "phèn chua" | "nhôm" | |
| Argon | Ar gon | Từ tiếng Hy Lạp "không hoạt động" | "argon" | |
| Bari | Ba rium | Từ tiếng Hy Lạp " nặng" | "bari" | |
| Bor | B orum | Từ tiếng Ả Rập "khoáng trắng" | "boron" | |
| Brom | anhừm | Từ tiếng Hy Lạp "hôi" | "brôm" | |
| Hydro | H hydroi | Từ tiếng Hy Lạp "sinh ra nước" | "tro" | |
| Heli | Anh ta cây lilium | Từ tiếng Hy Lạp " Mặt trời" | "heli" | |
| Sắt | Fe tiếng ầm ĩ | Từ lat. "thanh kiếm" | "ferrum" | |
| Vàng | Âu Rum | Từ lat. "đốt cháy" | "aurum" | |
| Iốt | TÔI mùi hôi | Từ tiếng Hy Lạp " màu tím" | "iốt" | |
| Kali | K ali | Từ tiếng Ả Rập "dung dịch kiềm" | "kali" | |
| canxi | Ca lxi | Từ lat. "đá vôi" | "canxi" | |
| Ôxy | ồ xygeni | Từ tiếng Hy Lạp "tạo axit" | "Ồ" | |
| Silicon | Sĩ cam thảo | Từ lat. "đá lửa" | "silic" | |
| Krypton | Kr ypton | Từ tiếng Hy Lạp "ẩn giấu" | "krypton" | |
| Magie | M Một g nesi | Từ cái tên Bán đảo Magnesia | "magie" | |
| Mangan | M Một N ganum | Từ tiếng Hy Lạp "làm sạch" | "mangan" | |
| Đồng | Cư mận | Từ tiếng Hy Lạp tên Ô. Síp | "cuprum" | |
| Natri | Na chiến thắng | Từ tiếng Ả Rập, “chất tẩy rửa” | "natri" | |
| neon | Ne TRÊN | Từ tiếng Hy Lạp " mới" | "neon" | |
| Niken | Ni colum | Từ Anh ấy. "Thánh Nicholas Đồng" | "niken" | |
| thủy ngân | H ydrar g yrum | Lạt. "bạc lỏng" | "hydrargyrum" | |
| Chỉ huy | P lum bừm | Từ lat. tên hợp kim của chì và thiếc | "dây mận" | |
| lưu huỳnh | S lưu huỳnh | Từ tiếng Phạn "bột dễ cháy" | "es" | |
| Bạc | MỘT r g chất vướng víu | Từ tiếng Hy Lạp " ánh sáng" | "argentum" | |
| Carbon | C cây gỗ | Từ lat. "than" | "tse" | |
| Phốt pho | P photpho | Từ tiếng Hy Lạp "người mang lại ánh sáng" | "peh" | |
| Flo | F luorum | Từ lat. Động từ “chảy” | "flo" | |
| clo | Cl orum | Từ tiếng Hy Lạp "hơi xanh" | "clo" | |
| crom | C h r omium | Từ tiếng Hy Lạp " thuốc nhuộm" | "trình duyệt Chrome" | |
| Caesium | C ae Sừm | Từ lat. "trời xanh" | "xêzi" | |
| kẽm | Z Tôi N kiêm | Từ Anh ấy. "thiếc" | "kẽm" | |
2.3. Công thức hóa học
Dùng để chỉ các chất hoá học công thức hóa học.
Đối với các chất phân tử, công thức hóa học có thể biểu thị một phân tử của chất này.
Thông tin về một chất có thể khác nhau, do đó có những các loại công thức hóa học.
Tùy thuộc vào mức độ đầy đủ của thông tin, công thức hóa học được chia thành bốn loại chính: động vật nguyên sinh,
phân tử, cấu trúc Và không gian.
Chỉ số trong công thức đơn giản nhất không có ước chung.
Chỉ số "1" không được sử dụng trong các công thức.
Ví dụ về các công thức đơn giản nhất: nước - H 2 O, oxy - O, lưu huỳnh - S, oxit photpho - P 2 O 5, butan - C 2 H 5, axit photphoric - H 3 PO 4, natri clorua (muối ăn) - NaCl.
Công thức đơn giản nhất của nước (H 2 O) cho thấy thành phần của nước gồm có nguyên tố hydro(H) và phần tử ôxy(O), và trong bất kỳ phần nào (một phần là một phần của thứ gì đó có thể phân chia mà không làm mất đi tính chất của nó.) của nước, số nguyên tử hydro gấp đôi số nguyên tử oxy.
Số lượng hạt, bao gồm số lượng nguyên tử, ký hiệu bằng chữ cái Latinh N. Biểu thị số lượng nguyên tử hydro - N H và số nguyên tử oxi là NỒ, chúng ta có thể viết điều đó
Hoặc N H: N O=2:1.
Công thức đơn giản nhất của axit photphoric (H 3 PO 4) cho thấy axit photphoric chứa các nguyên tử hydro, nguyên tử phốt pho và nguyên tử ôxy, và tỷ lệ số lượng nguyên tử của các nguyên tố này trong bất kỳ phần nào của axit photphoric là 3:1:4, nghĩa là
NH: N P: N O=3:1:4.

Công thức đơn giản nhất có thể được biên soạn cho bất kỳ chất hóa học riêng lẻ nào và cho một chất phân tử, ngoài ra, nó có thể được biên soạn công thức phân tử.
Ví dụ về công thức phân tử: nước - H 2 O, oxy - O 2, lưu huỳnh - S 8, oxit photpho - P 4 O 10, butan - C 4 H 10, axit photphoric - H 3 PO 4.
Các chất không phân tử không có công thức phân tử.
Trình tự viết các ký hiệu nguyên tố trong công thức phân tử và đơn giản được xác định bởi các quy tắc ngôn ngữ hóa học mà bạn sẽ làm quen khi nghiên cứu hóa học. Thông tin được truyền tải bởi các công thức này không bị ảnh hưởng bởi chuỗi ký hiệu.
Trong số các dấu hiệu phản ánh cấu trúc của chất, bây giờ chúng ta chỉ sử dụng đột quỵ hóa trị("dấu gạch ngang"). Dấu hiệu này cho thấy sự hiện diện giữa các nguyên tử của cái gọi là liên kết cộng hóa trị(đây là loại kết nối gì và tính năng của nó là gì, bạn sẽ sớm tìm ra).

Trong phân tử nước, nguyên tử oxy được kết nối bằng liên kết đơn giản (đơn) với hai nguyên tử hydro, nhưng các nguyên tử hydro không được kết nối với nhau. Đây chính xác là những gì công thức cấu trúc của nước thể hiện rõ ràng. ![]()
Một ví dụ khác: phân tử lưu huỳnh S8. Trong phân tử này, 8 nguyên tử lưu huỳnh tạo thành một vòng tám cạnh, trong đó mỗi nguyên tử lưu huỳnh được kết nối với hai nguyên tử khác bằng liên kết đơn giản. So sánh công thức cấu trúc của lưu huỳnh với mô hình ba chiều của phân tử của nó như trong hình. 3. Xin lưu ý rằng công thức cấu tạo của lưu huỳnh không thể hiện hình dạng phân tử của nó mà chỉ thể hiện trình tự liên kết các nguyên tử bằng liên kết cộng hóa trị.

Công thức cấu tạo của axit photphoric cho thấy trong phân tử của chất này, một trong bốn nguyên tử oxy chỉ được kết nối với nguyên tử phốt pho bằng liên kết đôi và nguyên tử phốt pho được kết nối với ba nguyên tử oxy nữa bằng liên kết đơn . Mỗi nguyên tử oxy này cũng được kết nối bằng một liên kết đơn giản với một trong ba nguyên tử hydro có trong phân tử.
So sánh mô hình ba chiều sau đây của phân tử metan với công thức không gian, cấu trúc và phân tử của nó:
|
|
|
Trong công thức không gian của metan, các nét hóa trị hình nêm, như thể theo phối cảnh, cho thấy nguyên tử hydro nào “gần chúng ta hơn” và nguyên tử nào “xa chúng ta hơn”.
Đôi khi công thức không gian biểu thị độ dài và góc liên kết giữa các liên kết trong phân tử, như được thể hiện trong ví dụ về phân tử nước.

Các chất phi phân tử không chứa phân tử. Để thuận tiện cho việc tính toán hóa học trong một chất phi phân tử, cái gọi là Đơn vị công thức.
Ví dụ về thành phần đơn vị công thức của một số chất: 1) silicon dioxide (cát thạch anh, thạch anh) SiO 2 – đơn vị công thức bao gồm một nguyên tử silicon và hai nguyên tử oxy; 2) natri clorua (muối ăn) NaCl – đơn vị công thức bao gồm một nguyên tử natri và một nguyên tử clo; 3) sắt Fe - đơn vị công thức bao gồm một nguyên tử sắt.Giống như một phân tử, đơn vị công thức là phần nhỏ nhất của một chất vẫn giữ được các đặc tính hóa học của nó.
Bảng 4
Thông tin được truyền tải bằng các loại công thức khác nhau
Loại công thức |
Thông tin được truyền tải bằng công thức. |
|
| Điều đơn giản nhất phân tử Cấu trúc không gian |
|
|
Bây giờ chúng ta hãy xem xét, sử dụng các ví dụ, những thông tin mà các loại công thức khác nhau cung cấp cho chúng ta.
1. Chất: A-xít a-xê-tíc. Công thức đơn giản nhất là CH 2 O, công thức phân tử là C 2 H 4 O 2, công thức cấu tạo

Công thức đơn giản nhất nói với chúng tôi rằng
1) axit axetic chứa cacbon, hydro và oxy;
2) trong chất này, số lượng nguyên tử carbon liên quan đến số lượng nguyên tử hydro và số lượng nguyên tử oxy, là 1: 2: 1, nghĩa là N H: N C: N O = 1:2:1.
Công thức phân tử thêm vào đó
3) Trong phân tử axit axetic có 2 nguyên tử cacbon, 4 nguyên tử hydro và 2 nguyên tử oxy.
Công thức cấu tạo thêm vào đó
4, 5) trong phân tử hai nguyên tử cacbon được nối với nhau bằng liên kết đơn giản; Ngoài ra, một trong số chúng được kết nối với ba nguyên tử hydro, mỗi nguyên tử có một liên kết đơn và nguyên tử kia với hai nguyên tử oxy, một nguyên tử có liên kết đôi và nguyên tử kia có liên kết đơn; nguyên tử oxy cuối cùng vẫn được kết nối bằng liên kết đơn giản với nguyên tử hydro thứ tư.
2. Chất: natri clorua.
Công thức đơn giản nhất là NaCl.
1) Natri clorua chứa natri và clo.
2) Trong chất này, số nguyên tử natri bằng số nguyên tử clo.
3. Chất: sắt.
Công thức đơn giản nhất là Fe.
1) Chất này chỉ chứa sắt, nghĩa là nó là một chất đơn giản.
4. Chất: axit trimetaphotphoric . Công thức đơn giản nhất là HPO 3, công thức phân tử là H 3 P 3 O 9, công thức cấu tạo

1) Axit trimetaphosphoric chứa hydro, phốt pho và oxy.
2) N H: N P: N O = 1:1:3.
3) Phân tử bao gồm ba nguyên tử hydro, ba nguyên tử phốt pho và chín nguyên tử oxy.
4, 5) Ba nguyên tử phốt pho và ba nguyên tử oxy xen kẽ nhau tạo thành một chu trình sáu cạnh. Tất cả các kết nối trong chu trình đều đơn giản. Ngoài ra, mỗi nguyên tử phốt pho còn được kết nối với hai nguyên tử oxy nữa, một nguyên tử có liên kết đôi và nguyên tử kia có liên kết đơn. Mỗi trong số ba nguyên tử oxy được kết nối bằng liên kết đơn giản với các nguyên tử phốt pho cũng được kết nối bằng liên kết đơn giản với nguyên tử hydro.
| Axit photphoric – H 3 PO 4(tên gọi khác là axit orthophosphoric) là chất kết tinh trong suốt, không màu, có cấu trúc phân tử, nóng chảy ở 42 o C. Chất này hòa tan rất tốt trong nước và thậm chí hấp thụ hơi nước từ không khí (hút ẩm). Axit photphoric được sản xuất với số lượng lớn và được sử dụng chủ yếu trong sản xuất phân lân, ngoài ra còn được sử dụng trong công nghiệp hóa chất, sản xuất diêm và thậm chí trong xây dựng. Ngoài ra, axit photphoric còn được sử dụng trong sản xuất xi măng trong công nghệ nha khoa và được đưa vào nhiều loại thuốc. Axit này khá rẻ nên ở một số nước, chẳng hạn như Mỹ, axit photphoric rất tinh khiết, pha loãng với nước, được thêm vào đồ uống giải khát để thay thế axit xitric đắt tiền. |
| Mêtan - CH4. Nếu bạn có bếp gas ở nhà thì bạn sẽ gặp phải chất này hàng ngày: khí tự nhiên cháy trong đầu đốt của bếp của bạn bao gồm 95% khí mê-tan. Khí mê-tan là chất khí không màu, không mùi, có nhiệt độ sôi –161 o C. Khi trộn với không khí, nó dễ nổ, điều này giải thích tại sao thỉnh thoảng xảy ra các vụ nổ, cháy ở các mỏ than (tên gọi khác của khí mê-tan là fireamp). Tên thứ ba của khí mê-tan - khí đầm lầy - là do bong bóng của loại khí đặc biệt này nổi lên từ đáy đầm lầy, nơi nó được hình thành do hoạt động của một số vi khuẩn. Trong công nghiệp, khí mêtan được dùng làm nhiên liệu, nguyên liệu để sản xuất các chất khác. hidrocacbon. Nhóm chất này còn bao gồm ethane (C 2 H 6), propan (C 3 H 8), ethylene (C 2 H 4), acetylene (C 2 H 2) và nhiều chất khác. |
Bảng 5.Ví dụ về các loại công thức khác nhau của một số chất-
Asen(tiếng Latin arsenicum), là nguyên tố hóa học nhóm V của hệ tuần hoàn Mendeleev, số nguyên tử 33, khối lượng nguyên tử 74,9216; tinh thể màu xám thép. Nguyên tố này bao gồm một đồng vị ổn định 75 as.
Tài liệu tham khảo lịch sử. Các hợp chất tự nhiên của khoáng chất với lưu huỳnh (orpiment là 2 s 3, realgar là 4 s 4) đã được các dân tộc ở thế giới cổ đại biết đến, những người đã sử dụng các khoáng chất này làm thuốc và sơn. Sản phẩm đốt cháy M. sulfua còn được gọi là - M. oxit (iii) là 2 o 3 (“M trắng.”). Cái tên arsenik on n đã được tìm thấy trong Aristotle; nó có nguồn gốc từ tiếng Hy Lạp. rsen - mạnh mẽ, can đảm và dùng để chỉ các hợp chất M (theo tác dụng mạnh của chúng đối với cơ thể). Tên tiếng Nga được cho là xuất phát từ “chuột” (từ việc sử dụng chế phẩm M. để tiêu diệt chuột nhắt và chuột cống). Việc nhận được M. ở trạng thái tự do là do Albert Đại Đế(khoảng 1250). Năm 1789 A. Lavoisierđưa M. vào danh mục các nguyên tố hóa học.
Phân bố trong tự nhiên. Hàm lượng trung bình của kim loại trong lớp vỏ trái đất (clarke) là 1,7 × 10 -4% (theo khối lượng); nó hiện diện với số lượng như vậy trong hầu hết các loại đá lửa. Vì các hợp chất M. dễ bay hơi ở nhiệt độ cao nên nguyên tố này không tích lũy trong quá trình magma; nó cô đặc, kết tủa từ vùng nước sâu nóng (cùng với s, se, sb, fe, co, ni, cu và các nguyên tố khác). Trong quá trình phun trào núi lửa, các khoáng chất xâm nhập vào khí quyển dưới dạng các hợp chất dễ bay hơi của chúng. Vì M. có nhiều hóa trị nên sự di chuyển của nó bị ảnh hưởng rất nhiều bởi môi trường oxi hóa khử. Trong điều kiện oxy hóa bề mặt trái đất, arsenate (5+) và arsenite (3+) được hình thành. Đây là những loại khoáng sản quý hiếm, chỉ được tìm thấy ở những khu vực có trữ lượng khoáng sản.Khoáng sản bản địa và khoáng chất 2+ thậm chí còn ít phổ biến hơn. Trong số rất nhiều khoáng chất của M. (khoảng 180), chỉ có đá arsenopyrite là có tầm quan trọng hàng đầu trong công nghiệp.
Một lượng nhỏ M. cần thiết cho sự sống. Tuy nhiên, ở những khu vực có trữ lượng khoáng sản và hoạt động của núi lửa trẻ, đất ở một số nơi chứa tới 1% kim loại, có liên quan đến bệnh vật nuôi và cái chết của thảm thực vật. Sự tích tụ của M. đặc biệt đặc trưng ở cảnh quan thảo nguyên và sa mạc, ở những vùng đất mà M. không hoạt động. Ở vùng khí hậu ẩm ướt, M. dễ bị cuốn trôi khỏi đất.
Trong vật chất sống có trung bình là 3 × 10 -5% M, ở sông là 3 × 10 -7%. M., được các con sông đưa ra biển, định cư tương đối nhanh chóng. Trong nước biển chỉ có 1 x 10 -7% M nhưng trong đất sét và đá phiến là 6,6 x 10 -4%. Quặng sắt trầm tích và các nốt ferromanganese thường được làm giàu ở M.
Các tính chất vật lý và hóa học. M. có một số sửa đổi đẳng hướng. Trong điều kiện bình thường, ổn định nhất là cái gọi là kim loại, hoặc màu xám, M. (a -as) - một khối tinh thể giòn màu xám thép; Khi mới nứt ra, nó có ánh kim loại, trong không khí nó nhanh chóng mờ đi vì được bao phủ bởi một lớp màng mỏng cỡ 2 o 3. Mạng tinh thể của M. màu xám có dạng hình thoi ( MỘT= 4,123 a, góc a = 54°10", X= 0,226), xếp lớp. Mật độ 5,72 g/cm3(ở 20°c), điện trở suất 35 10 -8 om? tôi, hoặc 35 10 -6 om? cmt, hệ số nhiệt độ của điện trở 3,9 10 -3 (0°-100°c), độ cứng Brinell 1470 triệu/m2, hoặc 147 kgf/mm 2(3-4 theo Mohs); M. nghịch từ. Dưới áp suất khí quyển, kim loại thăng hoa ở 615 °C mà không nóng chảy, vì điểm ba a -as nằm ở 816 °C và áp suất 36 Tại. Hơi nước M. bao gồm 4 phân tử ở nhiệt độ lên tới 800 ° C, trên 1700 ° C - chỉ có 2 phân tử. Khi hơi kim loại ngưng tụ trên bề mặt được làm lạnh bằng không khí lỏng sẽ tạo thành kim loại màu vàng - tinh thể trong suốt, mềm như sáp, có khối lượng riêng 1,97 g/cm3, có tính chất tương tự như màu trắng phốt pho. Khi tiếp xúc với ánh sáng hoặc nhiệt độ yếu, nó biến thành M. màu xám. Các biến thể vô định hình thủy tinh còn được gọi là: M. đen và M. nâu, biến thành M màu xám khi bị nung nóng trên 270°c.
Cấu hình electron lớp ngoài của nguyên tử M. 3 d 10 4 S 2 4 P 3. Trong các hợp chất, M có trạng thái oxy hóa +5, +3 và – 3. Màu xám M hoạt động hóa học kém hơn đáng kể so với phốt pho. Khi đun nóng trong không khí ở nhiệt độ trên 400°c, M cháy, tạo thành 2 o 3. M kết hợp trực tiếp với halogen; trong điều kiện bình thường asf 5 - khí; asf 3, ascl 3, asbr 3 - chất lỏng không màu, dễ bay hơi; asi 3 và asi 2 l 4 - tinh thể màu đỏ. Khi nung M. với lưu huỳnh, thu được các sunfua sau: màu đỏ cam là 4 s 4 và màu vàng chanh là 2 s 3. Sunfua màu vàng nhạt ở 2 s 5 được kết tủa bằng cách cho h 2 s vào dung dịch axit arsenic (hoặc muối của nó) đã được làm lạnh bằng nước đá trong axit clohydric bốc khói: 2h 3 aso 4 + 5h 2 s = as 2 s 5 + 8h 2 o ; Ở nhiệt độ khoảng 500°c nó phân hủy thành 2 s 3 và lưu huỳnh. Tất cả M. sulfua đều không tan trong nước và axit loãng. Các tác nhân oxy hóa mạnh (hỗn hợp hno 3 + hcl, hcl + kclo 3) chuyển chúng thành hỗn hợp h 3 aso 4 và h 2 so 4. Sunfua ở dạng 2 s 3 dễ dàng hòa tan trong sunfua và polysulfua của amoni và kim loại kiềm, tạo thành muối của axit - thioarsenic h 3 ass 3 và thioarsenic h 3 ass 4. Với oxy, M. tạo ra các oxit: M. oxit (iii) ở dạng 2 o 3 - arsenic anhydrit và M. oxit (v) ở dạng 2 o 5 - arsenic anhydrit. Loại đầu tiên trong số chúng được hình thành do tác dụng của oxy với kim loại hoặc sunfua của nó, ví dụ 2as 2 s 3 + 9o 2 = 2as 2 o 3 + 6so 2. Khi 2 o 3 hơi ngưng tụ thành khối thủy tinh không màu, khối này trở nên đục theo thời gian do hình thành các tinh thể lập phương nhỏ, mật độ 3,865 g/cm3. Mật độ hơi tương ứng với công thức là 4 o 6: trên 1800°c hơi nước bao gồm 2 o 3. Ở mức 100 G nước hòa tan 2.1 G là 2 o 3 (ở 25°c). M. oxit (iii) là một hợp chất lưỡng tính, với tính chất axit chiếm ưu thế. Các muối (arsenit) tương ứng với axit orthoarsenic h 3 aso 3 và metaarsenic haso 2 đã được biết đến; bản thân axit vẫn chưa thu được. Chỉ có kim loại kiềm và amoni arsenit hòa tan trong nước. như 2 o 3 và arsenit thường là chất khử (ví dụ, như 2 o 3 + 2i 2 + 5h 2 o = 4hi + 2h 3 aso 4), nhưng cũng có thể là tác nhân oxy hóa (ví dụ, như 2 o 3 + 3c = 2as + 3co ).
M. oxit (v) thu được bằng cách đun nóng axit arsenic h 3 aso 4 (khoảng 200°c). Nó không màu, ở khoảng 500°c nó phân hủy thành 2 o 3 và o 2. Axit arsenic thu được bằng cách cho hno 3 đậm đặc tác dụng với hoặc theo 2 o 3. Muối axit asen (arsenat) không hòa tan trong nước, ngoại trừ kim loại kiềm và muối amoni. Các muối được biết là tương ứng với các axit orthoarsenic h 3 aso 4 , metaarsenic haso 3 , và axit pyroarsenic h 4 là 2 o 7 ; hai axit cuối cùng không thu được ở trạng thái tự do. Khi kết hợp với kim loại, kim loại chủ yếu tạo thành hợp chất ( arsenit).
Tiếp nhận và sử dụng . M. được sản xuất công nghiệp bằng cách nung pyrit arsen:
feass = fes + như
hoặc (ít thường xuyên hơn) giảm 2 đến 3 với than. Cả hai quá trình đều được thực hiện trong các bình chưng cất làm bằng đất sét chịu lửa, được nối với một máy thu để ngưng tụ hơi M. Asen anhydrit thu được bằng cách nung oxy hóa quặng asen hoặc là sản phẩm phụ của quá trình nung quặng đa kim, hầu như luôn chứa M. Trong quá trình nung rang oxy hóa, khi 2 o 3 hơi được hình thành, ngưng tụ thành các buồng hứng. Dầu thô ở mức 2 o 3 được tinh chế bằng cách thăng hoa ở 500-600°c. Tinh chế ở mức 2 o 3 được sử dụng để sản xuất M. và các chế phẩm của nó.
Các chất phụ gia nhỏ M (0,2-1,0% trọng lượng) được đưa vào chì dùng để sản xuất đạn súng (M làm tăng sức căng bề mặt của chì nóng chảy, do đó đạn có hình dạng gần giống hình cầu; M tăng nhẹ độ cứng của chì). Là chất thay thế một phần cho antimon, M. được đưa vào một số babbitt và hợp kim in ấn.
M. nguyên chất không độc, nhưng tất cả các hợp chất của nó hòa tan trong nước hoặc có thể tan thành dung dịch dưới tác dụng của dịch dạ dày đều cực độc; đặc biệt nguy hiểm arsen hydro. Trong số các hợp chất M được sử dụng trong sản xuất, arsenous anhydrit là chất độc nhất. Hầu như tất cả các quặng sunfua của kim loại màu, cũng như pyrit sắt (lưu huỳnh) đều chứa phụ gia kim loại. Do đó, trong quá trình rang oxy hóa của chúng, cùng với sulfur dioxide nên 2, vì 2 o 3 luôn được hình thành; Hầu hết nó ngưng tụ trong các kênh khói, nhưng do thiếu hoặc có hiệu suất xử lý thấp nên khí thải của các lò quặng mang đi một lượng đáng kể là 2 o 3. M. nguyên chất tuy không độc nhưng luôn được bao phủ bởi một lớp chất độc có tỷ lệ 2 o 3 khi bảo quản trong không khí. Trong trường hợp không có hệ thống thông gió thích hợp, việc ăn mòn kim loại (sắt, kẽm) bằng axit sulfuric hoặc hydrochloric công nghiệp có chứa hỗn hợp kim loại là cực kỳ nguy hiểm, vì điều này tạo ra hydro arsen.
S. A. Pogodin.
M. trong cơ thể. BẰNG nguyên tố vi lượng M. có mặt khắp nơi trong thiên nhiên sống. Hàm lượng M trung bình trong đất là 4 · 10 -4%, trong tro thực vật - 3 · 10 -5%. Hàm lượng M trong sinh vật biển cao hơn sinh vật trên cạn (ở cá 0,6-4,7 mg trong 1 Kilôgam chất thô tích tụ ở gan). Hàm lượng M trung bình trong cơ thể con người là 0,08-0,2 mg/kg. Trong máu, M. tập trung ở hồng cầu, nơi nó liên kết với phân tử hemoglobin (và phần globin chứa nhiều gấp đôi heme). Số lượng lớn nhất của nó (trên 1 G mô) được tìm thấy ở thận và gan. Rất nhiều M. được tìm thấy trong phổi và lá lách, da và tóc; tương đối ít - trong dịch não tủy, não (chủ yếu là tuyến yên), tuyến sinh dục, v.v. Trong các mô, M. được tìm thấy trong phần protein chính, ít hơn nhiều trong phần hòa tan trong axit và chỉ một phần nhỏ trong số đó được tìm thấy. tìm thấy trong phần lipid. M. tham gia vào các phản ứng oxy hóa khử: phân hủy oxy hóa các carbohydrate phức tạp, lên men, glycolysis, v.v. Các hợp chất M. được sử dụng đặc biệt trong hóa sinh chất ức chế enzyme để nghiên cứu các phản ứng trao đổi chất.
M. trong y học. Các hợp chất hữu cơ của M. (aminarsone, miarsenol, novarsenal, osarsol) được sử dụng chủ yếu để điều trị bệnh giang mai và các bệnh đơn bào. Các chế phẩm vô cơ của M. - natri arsenit (natri arsenat), kali arsenit (kali arsenat), arsenic anhydrit 2 o 3, được kê đơn làm thuốc tăng lực, thuốc bổ tổng hợp. Khi bôi tại chỗ, các chế phẩm M. vô cơ có thể gây ra tác dụng hoại tử mà không gây kích ứng trước đó, khiến quá trình này hầu như không gây đau đớn; Đặc tính này, được thể hiện rõ nhất ở dạng 2 o 3, được sử dụng trong nha khoa để phá hủy tủy răng. Các chế phẩm M. vô cơ cũng được sử dụng để điều trị bệnh vẩy nến.
Đồng vị phóng xạ thu được nhân tạo M. 74 là (t 1 / 2 = 17,5 ngày) và 76 là (t 1/2 = 26,8 h) được sử dụng cho mục đích chẩn đoán và điều trị. Với sự giúp đỡ của họ, vị trí của các khối u não được làm rõ và mức độ triệt để của việc loại bỏ chúng được xác định. Chất phóng xạ M. đôi khi được sử dụng cho các bệnh về máu, v.v.
Theo khuyến nghị của Ủy ban Quốc tế về Bảo vệ Bức xạ, hàm lượng tối đa cho phép trong cơ thể là 76 là 11. mcurie. Theo tiêu chuẩn vệ sinh được thông qua ở Liên Xô, nồng độ tối đa cho phép là 76 trong nước và các hồ chứa mở là 1 10 -7 curie/l, trong không khí nơi làm việc 5 10 -11 curie/l. Tất cả các chế phẩm của M. đều rất độc. Trong trường hợp ngộ độc cấp tính, quan sát thấy đau bụng dữ dội, tiêu chảy và tổn thương thận; Có thể bị suy sụp và co giật. Trong ngộ độc mãn tính, phổ biến nhất là rối loạn tiêu hóa, viêm niêm mạc đường hô hấp (viêm họng, viêm thanh quản, viêm phế quản), tổn thương da (phát ban, hắc tố, tăng sừng) và rối loạn nhạy cảm; sự phát triển của bệnh thiếu máu bất sản là có thể. Trong điều trị ngộ độc thuốc M., unithiol có tầm quan trọng lớn nhất.
Các biện pháp ngăn ngừa ngộ độc công nghiệp chủ yếu nhằm mục đích cơ giới hóa, niêm phong và loại bỏ bụi trong quy trình công nghệ, tạo hệ thống thông gió hiệu quả và cung cấp cho người lao động thiết bị bảo hộ cá nhân khỏi tiếp xúc với bụi. Việc khám sức khỏe định kỳ cho người lao động là cần thiết. Kiểm tra y tế sơ bộ được thực hiện khi tuyển dụng và đối với nhân viên - sáu tháng một lần.
Lít.: Remi G., Khóa học hóa học vô cơ, trans. từ tiếng Đức, tập 1, M., 1963, tr. 700-712; Pogodin S. A., Arsenic, trong cuốn: Bách khoa toàn thư hóa học tóm tắt, tập 3, M., 1964; Các chất có hại trong công nghiệp nói chung. biên tập. N. V. Lazareva, tái bản lần thứ 6, phần 2, Leningrad, 1971.
tải xuống bản tóm tắt
Hướng dẫn
Hệ thống tuần hoàn là một “ngôi nhà” nhiều tầng chứa một số lượng lớn căn hộ. Mỗi “người thuê nhà” hoặc trong căn hộ của riêng mình theo một số lượng nhất định, là vĩnh viễn. Ngoài ra, nguyên tố này còn có “họ” hoặc tên, chẳng hạn như oxy, boron hoặc nitơ. Ngoài dữ liệu này, mỗi “căn hộ” còn chứa thông tin như khối lượng nguyên tử tương đối, có thể có giá trị chính xác hoặc làm tròn.
Như trong bất kỳ ngôi nhà nào, đều có “lối vào”, cụ thể là các nhóm. Hơn nữa, trong các nhóm, các phần tử nằm ở bên trái và bên phải, tạo thành. Tùy theo bên nào có nhiều hơn mà bên đó gọi là bên chính. Nhóm con còn lại, theo đó, sẽ chỉ là thứ yếu. Bảng cũng có “tầng” hoặc dấu chấm. Hơn nữa, các khoảng thời gian có thể vừa lớn (bao gồm hai hàng) vừa nhỏ (chỉ có một hàng).
Bảng này cho thấy cấu trúc nguyên tử của một nguyên tố, mỗi nguyên tố có hạt nhân tích điện dương bao gồm các proton và neutron, cũng như các electron tích điện âm quay xung quanh nó. Số lượng proton và electron giống nhau về số lượng và được xác định trong bảng bằng số thứ tự của nguyên tố. Ví dụ, nguyên tố hóa học lưu huỳnh là #16 nên nó sẽ có 16 proton và 16 electron.
Để xác định số lượng neutron (các hạt trung tính cũng nằm trong hạt nhân), hãy trừ số nguyên tử của nó khỏi khối lượng nguyên tử tương đối của nguyên tố. Ví dụ, sắt có khối lượng nguyên tử tương đối là 56 và số nguyên tử là 26. Do đó, 56 – 26 = 30 proton đối với sắt.
Các electron nằm ở những khoảng cách khác nhau so với hạt nhân, tạo thành các mức electron. Để xác định số lượng mức điện tử (hoặc năng lượng), bạn cần xem xét số khoảng thời gian mà phần tử đó nằm. Ví dụ nhôm đang ở kỳ thứ 3 nên sẽ có 3 cấp độ.
Bằng số nhóm (nhưng chỉ dành cho nhóm con chính), bạn có thể xác định hóa trị cao nhất. Ví dụ, các nguyên tố thuộc nhóm thứ nhất của phân nhóm chính (lithium, natri, kali, v.v.) có hóa trị bằng 1. Theo đó, các nguyên tố thuộc nhóm thứ hai (beryllium, magie, canxi, v.v.) sẽ có hóa trị là 2.
Bạn cũng có thể sử dụng bảng để phân tích thuộc tính của các phần tử. Từ trái sang phải, tính kim loại yếu đi và tính phi kim tăng lên. Điều này được thấy rõ trong ví dụ của giai đoạn 2: nó bắt đầu với natri kim loại kiềm, sau đó là magie kim loại kiềm thổ, sau đó là nguyên tố lưỡng tính nhôm, sau đó là silicon phi kim loại, phốt pho, lưu huỳnh và giai đoạn kết thúc bằng các chất khí - clo và argon. Trong giai đoạn tiếp theo, sự phụ thuộc tương tự cũng được quan sát thấy.
Từ trên xuống dưới, người ta cũng quan sát thấy một mô hình - tính chất kim loại tăng lên và tính chất phi kim loại yếu đi. Đó là, ví dụ, xêzi hoạt động mạnh hơn nhiều so với natri.
Asen là nguyên tố hóa học thuộc nhóm nitơ (nhóm 15 của bảng tuần hoàn). Nó là một chất giòn, màu xám có ánh kim loại (α-arsenic), có mạng tinh thể hình thoi. Khi đun nóng đến 600°C, As thăng hoa. Khi hơi nguội đi, một biến thể mới xuất hiện - asen màu vàng. Trên 270°C, tất cả các dạng As đều chuyển thành asen đen.
Lịch sử khám phá
Asen được biết đến từ lâu trước khi nó được công nhận là một nguyên tố hóa học. Vào thế kỷ thứ 4. BC đ. Aristotle đã đề cập đến một chất gọi là sandarac, chất này ngày nay được cho là realgar, hay arsenic sulfide. Và vào thế kỷ thứ 1 sau Công nguyên. đ. các nhà văn Pliny the Elder và Pedanius Dioscorides đã mô tả thư hoàng - thuốc nhuộm As 2 S 3. Vào thế kỷ 11 N. đ. Có ba loại “thạch tín”: trắng (As 4 O 6), vàng (As 2 S 3) và đỏ (As 4 S 4). Bản thân nguyên tố này có lẽ được phân lập lần đầu tiên vào thế kỷ 13 bởi Albertus Magnus, người đã chú ý đến sự xuất hiện của một chất giống kim loại khi arsenicum, một tên gọi khác của As 2 S 3, được đun nóng bằng xà phòng. Nhưng không có gì chắc chắn rằng nhà khoa học tự nhiên này đã thu được asen tinh khiết. Bằng chứng xác thực đầu tiên về sự cô lập thuần túy có từ năm 1649. Dược sĩ người Đức Johann Schröder đã điều chế asen bằng cách nung oxit của nó với sự có mặt của than. Sau đó, Nicolas Lemery, một bác sĩ và nhà hóa học người Pháp, đã quan sát sự hình thành của nguyên tố hóa học này bằng cách đun nóng hỗn hợp oxit, xà phòng và kali của nó. Vào đầu thế kỷ 18, asen đã được biết đến như một bán kim loại độc đáo.
Tỷ lệ hiện mắc
Trong lớp vỏ trái đất, nồng độ asen thấp và lên tới 1,5 ppm. Nó được tìm thấy trong đất và khoáng chất và có thể được thải vào không khí, nước và đất thông qua xói mòn do gió và nước. Ngoài ra, nguyên tố này đi vào khí quyển từ các nguồn khác. Do các vụ phun trào núi lửa, khoảng 3 nghìn tấn asen được thải vào không khí mỗi năm, các vi sinh vật tạo ra 20 nghìn tấn methylarsine dễ bay hơi mỗi năm và do quá trình đốt cháy nhiên liệu hóa thạch, 80 nghìn tấn được thải ra trên trái đất. cùng thời kỳ.
Mặc dù thực tế As là một chất độc chết người nhưng nó vẫn là thành phần quan trọng trong chế độ ăn của một số động vật và có thể cả con người, mặc dù liều lượng yêu cầu không vượt quá 0,01 mg/ngày.
Asen cực kỳ khó chuyển sang trạng thái hòa tan trong nước hoặc dễ bay hơi. Thực tế là nó khá di động có nghĩa là nồng độ lớn của chất này không thể xuất hiện ở bất kỳ nơi nào. Một mặt, đây là một điều tốt, nhưng mặt khác, sự lây lan dễ dàng của nó là lý do tại sao ô nhiễm asen đang trở thành một vấn đề lớn hơn. Do hoạt động của con người, chủ yếu thông qua khai thác và nấu chảy, nguyên tố hóa học thường bất động này di chuyển và hiện có thể được tìm thấy ở những nơi khác ngoài nơi tập trung tự nhiên của nó.
Lượng asen trong vỏ trái đất là khoảng 5 g mỗi tấn. Trong không gian, nồng độ của nó được ước tính là 4 nguyên tử trên một triệu nguyên tử silicon. Yếu tố này là phổ biến. Một lượng nhỏ của nó hiện diện ở trạng thái bản địa. Theo quy định, các dạng asen có độ tinh khiết 90-98% được tìm thấy cùng với các kim loại như antimon và bạc. Tuy nhiên, hầu hết trong số đó có trong hơn 150 khoáng chất khác nhau - sunfua, arsenide, sulfoarsenide và arsenite. Arsenopyrite FeAsS là một trong những khoáng chất chứa As phổ biến nhất. Các hợp chất arsen phổ biến khác là khoáng vật realgar As 4 S 4, thư hoàng As 2 S 3, lellingit FeAs 2 và enargit Cu 3 AsS 4. Oxit asen cũng phổ biến. Hầu hết chất này là sản phẩm phụ của quá trình nấu chảy quặng đồng, chì, coban và vàng.
Trong tự nhiên, chỉ có một đồng vị ổn định của asen - 75 As. Trong số các đồng vị phóng xạ nhân tạo, nổi bật nhất là 76 As với chu kỳ bán rã 26,4 giờ, Arsenic-72, -74 và -76 được sử dụng trong chẩn đoán y tế.

Sản xuất và ứng dụng công nghiệp
Asen kim loại thu được bằng cách nung arsenopyrite đến 650-700°C mà không cần tiếp cận với không khí. Nếu arsenopyrite và các quặng kim loại khác được nung nóng bằng oxy thì As dễ dàng kết hợp với nó, tạo thành As 4O 6 dễ thăng hoa hay còn gọi là “asen trắng”. Hơi oxit được thu thập và ngưng tụ, sau đó được tinh chế bằng cách thăng hoa lặp đi lặp lại. Hầu hết As được tạo ra bằng cách khử nó bằng carbon từ asen trắng thu được.
Mức tiêu thụ kim loại asen trên toàn cầu tương đối nhỏ - chỉ vài trăm tấn mỗi năm. Hầu hết những gì được tiêu thụ đều đến từ Thụy Điển. Nó được sử dụng trong luyện kim do tính chất kim loại của nó. Khoảng 1% asen được sử dụng trong sản xuất đạn chì vì nó cải thiện độ tròn của giọt nóng chảy. Các đặc tính của hợp kim ổ trục gốc chì cải thiện cả về nhiệt và cơ học khi chúng chứa khoảng 3% asen. Sự hiện diện của một lượng nhỏ nguyên tố hóa học này trong hợp kim chì làm cứng chúng để sử dụng trong pin và áo giáp cáp. Các tạp chất asen nhỏ làm tăng khả năng chống ăn mòn và tính chất nhiệt của đồng và đồng thau. Ở dạng nguyên chất, nguyên tố hóa học As được sử dụng để phủ đồng và trong pháo hoa. Asen có độ tinh khiết cao có ứng dụng trong công nghệ bán dẫn, trong đó nó được sử dụng với silicon và germani, và ở dạng gali arsenide (GaAs) trong điốt, laser và bóng bán dẫn.

Là kết nối
Vì hóa trị của asen là 3 và 5, đồng thời nó có khoảng trạng thái oxy hóa từ -3 đến +5, nên nguyên tố này có thể tạo thành các loại hợp chất khác nhau. Các dạng quan trọng nhất về mặt thương mại của nó là As 4 O 6 và As 2 O 5 . Ôxít asen, thường được gọi là asen trắng, là sản phẩm phụ của quá trình nung quặng đồng, chì và một số kim loại khác, cũng như quặng arsenopyrite và sulfua. Nó là nguyên liệu ban đầu cho hầu hết các hợp chất khác. Nó cũng được sử dụng trong thuốc trừ sâu, làm chất khử màu trong sản xuất thủy tinh và làm chất bảo quản cho da. Asen pentoxit được hình thành khi asen trắng tiếp xúc với tác nhân oxy hóa (chẳng hạn như axit nitric). Nó là thành phần chính trong thuốc trừ sâu, thuốc diệt cỏ và chất kết dính kim loại.
Arsine (AsH 3), một loại khí độc không màu bao gồm asen và hydro, là một chất khác được biết đến. Chất này, còn được gọi là arsenic hydro, thu được bằng cách thủy phân arsenide kim loại và khử kim loại khỏi các hợp chất arsenic trong dung dịch axit. Nó đã được sử dụng làm chất pha tạp trong chất bán dẫn và làm tác nhân chiến tranh hóa học. Trong nông nghiệp, axit arsenic (H 3 AsO 4), arsenate chì (PbHAsO 4) và arsenate canxi [Ca 3 (AsO 4) 2], được sử dụng để khử trùng đất và kiểm soát sâu bệnh, có tầm quan trọng rất lớn.
Asen là nguyên tố hóa học tạo thành nhiều hợp chất hữu cơ. Ví dụ, Cacodyne (CH 3) 2 As−As(CH 3) 2 được sử dụng để điều chế chất hút ẩm (chất làm khô) axit cacodylic được sử dụng rộng rãi. Các hợp chất hữu cơ phức tạp của nguyên tố này được sử dụng trong điều trị một số bệnh, ví dụ như bệnh lỵ amip do vi sinh vật gây ra.

Tính chất vật lý
Asen là gì về tính chất vật lý của nó? Ở trạng thái ổn định nhất, nó là chất rắn giòn, màu xám thép, có độ dẫn nhiệt và điện thấp. Mặc dù một số dạng As giống kim loại, việc phân loại nó là phi kim là đặc tính chính xác hơn của asen. Còn có các dạng asen khác nhưng chúng chưa được nghiên cứu kỹ lưỡng, đặc biệt là dạng siêu bền màu vàng, gồm các phân tử As 4, giống như phốt pho trắng P 4. Asen thăng hoa ở nhiệt độ 613 °C và ở dạng hơi nó tồn tại dưới dạng phân tử As 4, không phân ly cho đến khi nhiệt độ khoảng 800 °C. Sự phân ly hoàn toàn thành phân tử As 2 xảy ra ở 1700 °C.

Cấu trúc nguyên tử và khả năng hình thành liên kết
Công thức điện tử của asen - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 - giống nitơ và phốt pho ở chỗ có 5 electron ở lớp vỏ ngoài, nhưng khác ở chỗ chúng có 18 electron ở lớp áp chót vỏ thay vì hai hoặc tám. Việc thêm 10 điện tích dương vào hạt nhân trong khi lấp đầy năm quỹ đạo 3d thường gây ra sự giảm tổng thể trong đám mây điện tử và tăng độ âm điện của các nguyên tố. Asen trong bảng tuần hoàn có thể được so sánh với các nhóm khác thể hiện rõ ràng mô hình này. Ví dụ, người ta thường chấp nhận rằng kẽm có độ âm điện cao hơn magie và gali hơn nhôm. Tuy nhiên, trong các nhóm tiếp theo, sự khác biệt này giảm dần và nhiều người không đồng ý rằng germanium có độ âm điện cao hơn silicon, mặc dù có rất nhiều bằng chứng hóa học. Sự chuyển đổi tương tự từ lớp vỏ 8 đến 18 nguyên tố từ phốt pho sang asen có thể làm tăng độ âm điện, nhưng điều này vẫn còn gây tranh cãi.
Sự giống nhau về lớp vỏ ngoài của As và P cho thấy rằng chúng có thể tạo thành 3 trên mỗi nguyên tử khi có thêm một cặp electron không liên kết. Do đó, trạng thái oxy hóa phải là +3 hoặc -3, tùy thuộc vào độ âm điện tương đối lẫn nhau. Cấu trúc của asen cũng gợi ý khả năng sử dụng quỹ đạo d bên ngoài để mở rộng octet, cho phép nguyên tố hình thành 5 liên kết. Nó chỉ được thực hiện khi phản ứng với flo. Sự hiện diện của cặp electron tự do để hình thành các hợp chất phức tạp (thông qua sự cho đi điện tử) trong nguyên tử As ít rõ rệt hơn nhiều so với phốt pho và nitơ.
Asen ổn định trong không khí khô nhưng biến thành oxit đen trong không khí ẩm. Hơi của nó dễ cháy, tạo thành As 2 O 3. Asen tự do là gì? Nó thực tế không bị ảnh hưởng bởi nước, kiềm và axit không oxy hóa, nhưng bị oxy hóa bởi axit nitric đến trạng thái +5. Halogen và lưu huỳnh phản ứng với asen và nhiều kim loại tạo thành arsenit.

Hóa phân tích
Chất asen có thể được phát hiện một cách định tính ở dạng chất màu vàng, kết tủa dưới ảnh hưởng của dung dịch axit clohydric 25%. Dấu vết của As thường được xác định bằng cách chuyển nó thành arsine, chất này có thể được phát hiện bằng thử nghiệm Marsh. Arsine phân hủy nhiệt tạo thành một tấm gương asen màu đen bên trong một ống hẹp. Theo phương pháp Gutzeit, một mẫu được tẩm arsine sẽ sẫm màu do giải phóng thủy ngân.
Đặc điểm độc tính của asen
Độc tính của nguyên tố này và các dẫn xuất của nó rất khác nhau, từ arsine cực kỳ độc hại và các dẫn xuất hữu cơ của nó cho đến As, tương đối trơ. Việc sử dụng asen được chứng minh bằng việc sử dụng các hợp chất hữu cơ của nó làm tác nhân chiến tranh hóa học (lewisite), chất gây phồng rộp và chất làm rụng lá (Chất Blue dựa trên hỗn hợp nước gồm 5% axit cacodylic và 26% muối natri của nó).
Nhìn chung, các dẫn xuất của nguyên tố hóa học này gây kích ứng da và gây viêm da. Việc bảo vệ khỏi hít phải bụi có chứa asen cũng được khuyến khích, nhưng hầu hết ngộ độc xảy ra qua đường tiêu hóa. Nồng độ tối đa cho phép của As trong bụi trong 8 giờ làm việc là 0,5 mg/m3. Đối với arsine, liều lượng giảm xuống 0,05 ppm. Ngoài việc sử dụng các hợp chất của nguyên tố hóa học này làm thuốc diệt cỏ và thuốc trừ sâu, việc sử dụng asen trong dược lý còn giúp thu được salvarsan, loại thuốc thành công đầu tiên chống lại bệnh giang mai.

Ảnh hưởng sức khỏe
Asen là một trong những nguyên tố độc hại nhất. Các hợp chất vô cơ của hóa chất này xuất hiện tự nhiên với số lượng nhỏ. Con người có thể tiếp xúc với asen thông qua thực phẩm, nước và không khí. Phơi nhiễm cũng có thể xảy ra khi da tiếp xúc với đất hoặc nước bị ô nhiễm.
Những người làm việc với nó, sống trong những ngôi nhà được xây bằng gỗ đã qua xử lý bằng nó và trên đất nông nghiệp nơi trước đây đã sử dụng thuốc trừ sâu cũng dễ bị phơi nhiễm.
Asen vô cơ có thể gây ra nhiều ảnh hưởng sức khỏe ở con người, chẳng hạn như kích ứng dạ dày và ruột, giảm sản xuất hồng cầu và bạch cầu, thay đổi da và kích ứng phổi. Người ta nghi ngờ rằng ăn phải một lượng đáng kể chất này có thể làm tăng nguy cơ phát triển ung thư, đặc biệt là ung thư da, phổi, gan và hệ bạch huyết.
Nồng độ asen vô cơ rất cao gây vô sinh và sảy thai ở phụ nữ, viêm da, giảm sức đề kháng của cơ thể đối với nhiễm trùng, các vấn đề về tim và tổn thương não. Ngoài ra, nguyên tố hóa học này có thể làm hỏng DNA.
Liều gây chết người của asen trắng là 100 mg.
Các hợp chất hữu cơ của nguyên tố này không gây ung thư hoặc gây tổn hại đến mã di truyền, nhưng liều lượng cao có thể gây hại cho sức khỏe con người, chẳng hạn như gây rối loạn thần kinh hoặc đau bụng.
Thuộc tính Như
Các tính chất vật lý và hóa học chính của asen như sau:
- Số nguyên tử là 33.
- Trọng lượng nguyên tử - 74,9216.
- Điểm nóng chảy của dạng màu xám là 814 ° C ở áp suất 36 atm.
- Mật độ của dạng màu xám là 5,73 g/cm3 ở 14 °C.
- Khối lượng riêng của dạng màu vàng là 2,03 g/cm3 ở 18 °C.
- Công thức điện tử của asen là 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3.
- Trạng thái oxy hóa - -3, +3, +5.
- Hóa trị của asen là 3,5.
Tất cả tên của các nguyên tố hóa học đều bắt nguồn từ tiếng Latin. Điều này trước hết là cần thiết để các nhà khoa học từ các quốc gia khác nhau có thể hiểu nhau.
Ký hiệu hóa học của các nguyên tố
Các nguyên tố thường được ký hiệu bằng các dấu hiệu hóa học (ký hiệu). Theo đề xuất của nhà hóa học Thụy Điển Berzelius (1813), các nguyên tố hóa học được chỉ định bằng chữ cái đầu hoặc chữ cái đầu và một trong các chữ cái tiếp theo trong tên Latin của một nguyên tố nhất định; Chữ cái đầu tiên luôn là chữ hoa, chữ cái thứ hai luôn là chữ thường. Ví dụ, hydro (Hydrogenium) được ký hiệu bằng chữ H, oxy (Oxygenium) bằng chữ O, lưu huỳnh (Lưu huỳnh) bằng chữ S; thủy ngân (Hydrargyrum) - chữ cái Hg, nhôm (Nhôm) - Al, sắt (Ferrum) - Fe, v.v.

Cơm. 1. Bảng các nguyên tố hóa học có tên bằng tiếng Latin và tiếng Nga.
Tên tiếng Nga của các nguyên tố hóa học thường là tên Latin với phần cuối được sửa đổi. Nhưng cũng có nhiều yếu tố có cách phát âm khác với nguồn Latin. Đây là những từ tiếng Nga bản địa (ví dụ: sắt) hoặc những từ được dịch (ví dụ: oxy).
Danh pháp hóa học
Danh pháp hóa học là tên gọi chính xác của các chất hóa học. Từ Latin nomenclatura dịch là “danh sách tên”
Ở giai đoạn đầu phát triển của hóa học, các chất được đặt tên tùy ý, ngẫu nhiên (tên tầm thường). Các chất lỏng dễ bay hơi cao được gọi là rượu, bao gồm “rượu clohydric” - dung dịch nước của axit clohydric, “rượu silitry” - axit nitric, “rượu amoni” - dung dịch nước amoniac. Chất lỏng và chất rắn dạng dầu được gọi là dầu, ví dụ, axit sulfuric đậm đặc được gọi là “dầu vitriol” và asen clorua được gọi là “dầu asen”.
Đôi khi các chất được đặt theo tên của người phát hiện ra chúng, ví dụ, “muối Glauber” Na 2 SO 4 * 10H 2 O, được nhà hóa học người Đức I. R. Glauber phát hiện vào thế kỷ 17.

Cơm. 2. Chân dung I. R. Glauber.
Tên cổ có thể chỉ mùi vị của chất, màu sắc, mùi, hình thức và tác dụng chữa bệnh. Một chất đôi khi có nhiều tên.
Vào cuối thế kỷ 18, các nhà hóa học biết không quá 150-200 hợp chất.
Hệ thống tên khoa học đầu tiên trong hóa học được phát triển vào năm 1787 bởi một ủy ban các nhà hóa học do A. Lavoisier đứng đầu. Danh pháp hóa học của Lavoisier là cơ sở cho việc tạo ra danh pháp hóa học quốc gia. Để các nhà hóa học từ các nước khác nhau có thể hiểu nhau thì danh pháp phải thống nhất. Hiện nay, việc xây dựng công thức hóa học và tên gọi của các chất vô cơ tuân theo hệ thống quy tắc danh pháp do ủy ban của Liên minh Hóa học thuần túy và ứng dụng quốc tế (IUPAC) xây dựng. Mỗi chất được biểu thị bằng một công thức, theo đó tên hệ thống của hợp chất được xây dựng.

Cơm. 3. A. Lavoisier.
Chúng ta đã học được gì?
Tất cả các nguyên tố hóa học đều có gốc Latin. Tên Latin của các nguyên tố hóa học thường được chấp nhận. Chúng được chuyển sang tiếng Nga bằng cách truy tìm hoặc dịch thuật. tuy nhiên, một số từ có nghĩa gốc tiếng Nga, chẳng hạn như đồng hoặc sắt. Tất cả các chất hóa học bao gồm các nguyên tử và phân tử đều phải tuân theo danh pháp hóa học. Hệ thống tên khoa học được phát triển đầu tiên bởi A. Lavoisier.